Representación digital de la molécula de ADN, mostrando la estructura helicoidal y la disposición de sus bases. Esta imagen ilustra el fundamento molecular de la herencia genética. Imagen creada con IA (OpenAI).
La genética es la ciencia que estudia cómo se transmite la vida y cómo se transforma. En el interior de cada organismo, desde los seres más simples hasta las formas más complejas, existe un lenguaje minucioso y silencioso escrito en moléculas de ADN. Este lenguaje no solo contiene las instrucciones necesarias para construir un cuerpo, sino también para guiar su desarrollo, adaptarlo a las circunstancias y permitir que la vida se renueve generación tras generación. Cada célula guarda, en sus genes, una historia que comenzó hace miles de millones de años y que continúa en cada nacimiento.
La idea de herencia ha acompañado a la humanidad desde los orígenes mismos de la cultura. Las civilizaciones antiguas ya intuían que entre padres e hijos había vínculos invisibles que iban más allá de los rasgos visibles o del parecido físico. Sin embargo, fue necesario recorrer un largo camino para empezar a desentrañar ese entramado oculto. Desde los experimentos silenciosos de Mendel en su jardín de guisantes hasta la irrupción de la biología molecular en el siglo XX, cada avance nos ha acercado a comprender que la vida se organiza siguiendo patrones regulares, que la información biológica se transmite con precisión y que incluso los pequeños cambios en esa información pueden tener consecuencias profundas.
Hoy sabemos que la genética no es una disciplina aislada, sino un puente que conecta múltiples áreas del conocimiento. Explica por qué existen familias de rasgos compartidos y, a la vez, una diversidad inmensa que hace a cada individuo irrepetible. Nos ayuda a entender el proceso de la evolución y cómo las especies se transforman con el tiempo. Permite desentrañar las causas de enfermedades hereditarias, comprender trastornos complejos que combinan predisposición genética y factores ambientales, y estudiar la variabilidad que existe en las poblaciones humanas y no humanas.
Pero la genética moderna va más allá de la simple observación de rasgos heredados. Ha entrado en el territorio de la información profunda: el análisis de los genes que regulan el metabolismo, el comportamiento, el desarrollo embrionario y la respuesta del organismo a los estímulos externos. La secuenciación del genoma humano abrió un horizonte completamente nuevo. Ahora disponemos de mapas detallados que permiten rastrear mutaciones, leer instrucciones antes inaccesibles y comparar nuestro material genético con el de otras especies para reconstruir la historia evolutiva de la vida.
A estas herramientas se suman disciplinas emergentes como la genómica, que estudia el genoma en su totalidad; la epigenética, que investiga los mecanismos que modifican la expresión de los genes sin alterar la secuencia del ADN; la transcriptómica y la proteómica, que examinan cómo la información genética se traduce en actividad celular; y la bioinformática, indispensable para manejar la enorme cantidad de datos que genera la investigación actual. La genética se ha convertido así en un sistema global que integra múltiples niveles de información biológica.
Junto a este desarrollo científico, la genética plantea preguntas éticas profundas. La capacidad de analizar predisposiciones, predecir riesgos o corregir mutaciones abre posibilidades que hace muy poco habrían parecido ciencia ficción. Sin embargo, también exige responsabilidad, reflexión y diálogo social, porque el conocimiento genético no solo afecta a individuos, sino también a familias enteras y, en algunos casos, a la humanidad en su conjunto.
Este artículo busca ofrecer una visión amplia y ordenada de este campo inmenso. No pretende ser exhaustivo, sino servir de guía clara y comprensible para adentrarse en uno de los territorios más fascinantes de la biología actual. La genética es, al mismo tiempo, una ciencia rigurosa, una ventana hacia la historia de la vida y una herramienta poderosa que está transformando la medicina, la investigación y nuestra comprensión de lo que significa existir como seres vivos. Conocerla es abrir una puerta a los procesos silenciosos que sostienen la vida, nos conectan con nuestros antepasados y nos proyectan hacia el futuro.
Sobre la herencia genética cronología:
- En 1866, los experimentos de Gregor Mendel muestran que los rasgos heredados pueden saltarse una generación, indicio de la acción de «partículas» luego llamadas genes.
- En 1904: Thomas Hunt Morgan muestra que las partículas de la herencia descritas por Mendel se encuentran en los cromosomas.
- En 1905, Nettie Stevens descubre los dos tipos de cromosoma que determina el sexo del óvulo fecundado.
- 1928: Experimentos con bacterias realizadas por Frederick Griffith muestran que los rasgos heredados se deben a sustancias químicas.
- 1941 George Beadle y Edward Tatum demuestran que los genes determinan la producción de enzimas y que cada gen codifica una proteína en particular.
- 1950: Barbara McClintock describe la acción de los genes que «saltan de un cromosoma a otro» y la capacidad de los mismos cromosomas para activar o desactivar genes.
- 1953 James Watson y Francis Crick crean una maqueta de la estructura de doble hélice del ADN.
- 1964 Marshall Niremberg y Philip Leder establecen que el ADN encarna el código genético de todos los seres vivos.
- 1973 Herbert Boyer y Stanley Cohen producen las primeras células genéticamente modificadas llamadas GM
- 1979 Frederick Sanger aplica una técnica para descifrar la secuencia de moléculas biológicas de cadena larga a la secuenciación del ADN
- En el año 2000 el proyecto genoma humano dirigido por Francis Collins presenta el primer borrador del mapa del genoma humano.
Gregor Mendel. Autor: Desconocido. Dominio Público. Original file (1,000 × 1,357 pixels, file size: 1,021 KB).

Gregor Mendel es considerado el padre de la genética moderna porque fue el primero en descubrir las leyes fundamentales que explican cómo se heredan los rasgos de una generación a otra. A mediados del siglo XIX, mientras cultivaba guisantes en el monasterio de Brno, observó con rigor matemático cómo ciertos caracteres —como el color o la altura— no se mezclaban al azar, sino que seguían reglas precisas. Mendel dedujo que los rasgos se transmiten mediante unidades discretas que hoy llamamos genes, anticipando conceptos como dominancia, segregación y transmisión independiente. Aunque su trabajo pasó desapercibido durante décadas, su redescubrimiento a comienzos del siglo XX permitió unificar biología, estadística y herencia en un marco científico sólido. Gracias a Mendel, la genética dejó de ser un misterio para convertirse en una disciplina experimental capaz de explicar la variación, la herencia y buena parte del funcionamiento de los organismos. Su influencia sigue vigente en la genética molecular contemporánea y en todo lo que hoy entendemos por biología hereditaria.
Herencia genética, genes y genómica: estudio avanzado
1.Introducción general
- 1.1 La genética como ciencia del lenguaje de la vida.
- 1.2 Importancia histórica y científica de la genética.
- 1.3 Conceptos clave y definiciones básicas
2. Fundamentos de la herencia genética
- 2.1 Principios básicos de la herencia.
- 2.2 Leyes de Mendel (dominancia, segregación, transmisión independiente).
- 2.3 Alelos, genotipo y fenotipo.
- 2.4 Herencia dominante, recesiva e intermedia.
- 2.5 Ejemplos prácticos de cruces genéticos (tablas de Punnett).
3. La estructura y función de los genes.
- 3.1 ¿Qué es un gen?.
- 3.2 Composición química del ADN: estructura de la doble hélice.
- 3.3 Diferencias entre ADN y ARN.
- 3.4 Organización del material genético (ADN, cromosomas, cromatina, histonas).
- 3.5 Genes estructurales y reguladores.
- 3.6 Mutaciones: tipos y consecuencias.
- 3.7 Regulación de la expresión génica.
4. Replicación del ADN y ciclo celular
- 4.1 Proceso de replicación del ADN.
- 4.2 Ciclo celular: fases y regulación (Interfase, Mitosis, Meiosis).
- 4.3 Diferencias entre mitosis y meiosis en la herencia genética.
5. Herencia humana y patrones hereditarios complejos
- 5.1 Herencia autosómica (dominante y recesiva).
- 5.2 Herencia ligada al sexo (ligada al cromosoma X o Y).
- 5.3 Herencia mitocondrial.
- 5.4 Herencia poligénica y multifactorial: influencia ambiental y genética.
- 5.5 Ejemplos prácticos: color de ojos, altura, diabetes tipo II, enfermedades cardíacas.
6. Técnicas avanzadas en genética molecular
- 6.1 PCR (Reacción en Cadena de la Polimerasa).
- 6.2 Electroforesis de ADN y secuenciación genética.
- 6.3 CRISPR/Cas9 y edición genética.
- 6.4 Ingeniería genética y organismos modificados genéticamente (OMG).
Anexo_: Cultivos y modificación genética: diversidad, crecimiento y futuro de la agricultura.
7. El proyecto Genoma Humano
- 7. 1 Historia y objetivos del proyecto Genoma Humano.
- 7.2 Resultados principales: el mapa del genoma humano.
- 7.3 Implicaciones científicas y médicas del mapa genómico humano.
- 7.4 Genómica comparativa (comparación del genoma humano con otras especies).
8. Genética de poblaciones
- 8.1 Conceptos básicos: frecuencia génica, deriva genética, selección natural.
- 8.2 Equilibrio de Hardy-Weinberg.
- 8.3 Migraciones, endogamia, y evolución en las poblaciones.
- 8.4 Aplicación en estudios evolutivos, antropológicos y médicos.
9. Epigenética
- 9.1 Conceptos básicos y definiciones: más allá del ADN.
- 9.2 Mecanismos epigenéticos (metilación, acetilación, modificación de histonas).
- 9.3 Herencia epigenética y transmisión generacional.
- 9.4 Influencia del medio ambiente sobre la epigenética (alimentación, estrés, exposición a tóxicos).
10. Genética médica y diagnóstico genético
- 10.1 Principales enfermedades genéticas humanas (hereditarias y adquiridas).
- 10.2 Diagnóstico prenatal y postnatal: amniocentesis, biopsia corial, cribado neonatal.
- 10.3 Medicina predictiva y personalizada (farmacogenómica).
- 10.4 Ética de las pruebas genéticas y manejo de resultados.
11. Bioética y genética
- 11.1 Debates éticos sobre manipulación genética y edición génica humana.
- 11.2 Confidencialidad y privacidad genética.
- 11.3 Genética y discriminación: riesgos éticos y sociales.
12. El futuro de la genética
- 12.1 Nuevas tecnologías: edición genética de precisión y terapia génica avanzada.
- 12.2 Aplicaciones emergentes: genética sintética y biología computacional.
- 12.3 Retos y perspectivas científicas, éticas y sociales.
Epílogo: Comprender, cuidar y transformar la vida.
1. Introducción general
1.1 La genética como ciencia del lenguaje de la vida
La genética es la rama de la biología que estudia cómo se transmite la información de una generación a otra. Esta información no se transfiere en abstracto, sino codificada en una molécula concreta: el ADN, una larga espiral de instrucciones que define las características fundamentales de cada ser vivo. Comprender la genética es, en esencia, aprender a leer el lenguaje profundo con el que está escrita la vida.
Durante siglos, la herencia de los rasgos era un misterio. Se intuía que ciertos caracteres pasaban de padres a hijos, pero no se sabía cómo ni por qué. Fue a partir del siglo XIX cuando, gracias al trabajo de científicos como Gregor Mendel, comenzaron a definirse leyes básicas sobre la transmisión de rasgos. Aun así, aquellas leyes eran solo la punta del iceberg. A lo largo del siglo XX, los investigadores demostraron que la información hereditaria tenía un soporte físico: los genes, compuestos de una sustancia química específica, el ácido desoxirribonucleico (ADN).
La genética moderna es mucho más que el estudio de la herencia. Se ha convertido en una disciplina transversal que conecta la biología molecular con la medicina, la evolución, la biotecnología, la agricultura, la informática y la ética. Gracias a ella, podemos comprender no solo por qué heredamos ciertos rasgos físicos, sino también cómo se originan las enfermedades genéticas, cómo evolucionan las especies o cómo podemos modificar organismos vivos para fines científicos y médicos.
Desde sus orígenes, la genética ha evolucionado desde la simple observación de rasgos visibles hasta el análisis minucioso de secuencias químicas microscópicas. Hitos como el descubrimiento de la doble hélice del ADN, la secuenciación del genoma humano, las técnicas de edición genética como CRISPR y los avances en epigenética han revelado que el código genético es dinámico, interactivo y en muchos aspectos aún enigmático.
En la Antigüedad ya se observaba que los hijos se parecían a sus padres, pero no se comprendía el mecanismo de esa herencia. Teorías como la preformación —que sostenía que el embrión ya estaba completamente formado en miniatura— dominaron el pensamiento entre los siglos XVII y XVIII. Aunque equivocadas, estas ideas retrasaron el descubrimiento de los verdaderos procesos hereditarios. Más cercana a la verdad fue la antigua teoría de la pangénesis, que planteaba que ambos progenitores contribuían con una «semilla» para formar al nuevo ser.
Gregor Mendel fue quien logró dar un paso decisivo. Estudiando rasgos en plantas de guisante, como la altura o el color, demostró que los rasgos no se heredan por simple mezcla, sino a través de unidades discretas (hoy llamadas genes), que se transmiten en pares y pueden saltarse generaciones. Usó guisantes por su facilidad de cultivo, su rápida reproducción y porque presentaban rasgos claramente diferenciables, lo que facilitaba su observación y análisis. Estudiando rasgos en plantas de guisante, como la altura o el color, demostró que los rasgos no se heredan por simple mezcla, sino a través de unidades discretas (hoy llamadas genes), que se transmiten en pares y pueden saltarse generaciones. Usó guisantes por su facilidad de cultivo y la claridad con que se expresaban sus rasgos. Sus resultados, publicados en 1866, no fueron reconocidos hasta principios del siglo XX, cuando investigadores como Sutton y Boveri identificaron a los cromosomas como portadores de estos genes, y Thomas Hunt Morgan los confirmó en sus estudios con moscas de la fruta.
En 1905, Nettie Stevens descubrió los cromosomas sexuales, lo que ayudó a entender la determinación del sexo. En 1928, Frederick Griffith demostró que las características hereditarias podían transmitirse mediante sustancias químicas, insinuando el papel fundamental del ADN. Poco después, Beadle y Tatum mostraron que ciertas mutaciones impedían la producción de enzimas específicas en mohos, lo que llevó a la conclusión de que cada gen contiene la información necesaria para fabricar una proteína.
Este vínculo entre gen y proteína permitió comprender cómo los genes afectan directamente al funcionamiento celular. Por ejemplo, una mutación en el gen que codifica la insulina —una hormona encargada de regular los niveles de azúcar en sangre— puede provocar diabetes. Así, se entendió que los genes no solo se heredan, sino que controlan funciones clave del organismo mediante la producción de proteínas. Por ejemplo, una mutación en un gen puede impedir la fabricación de la insulina, una hormona fundamental para el control del azúcar en sangre. El principio de «un gen, una enzima» evolucionó hasta el concepto más amplio de «un gen, una proteína», abarcando no solo enzimas, sino también hormonas, proteínas estructurales y otras.
En los años treinta, Barbara McClintock descubrió que los genes pueden cambiar de posición dentro del genoma. Esta movilidad genética, observada en su estudio con el maíz, supuso una revolución en el entendimiento del ADN. Además, demostró que los genes no siempre están activos: su actividad puede variar según el tipo de célula o el momento del desarrollo. y que no siempre están activos. Estos «genes saltarines» —o elementos transponibles— revolucionaron la visión de la genética como algo estático. También mostró que la actividad genética depende del tipo celular y del momento del desarrollo. Esta comprensión anticipó conceptos clave de la regulación genética.
En 1953, James Watson y Francis Crick, con datos clave obtenidos por Rosalind Franklin mediante difracción de rayos X, crearon el modelo de la doble hélice del ADN. Esta estructura explicaba su capacidad de autorreplicación: cada hebra contiene la información complementaria de la otra, lo que permite su copia exacta durante la división celular.
El ADN contiene las instrucciones necesarias para la vida. Está formado por genes, que a su vez codifican proteínas. Estas proteínas pueden ser enzimas, hormonas, señales químicas o componentes estructurales, y son fundamentales para que la célula viva y funcione. El ADN se organiza en cromosomas, y su capacidad para autorreplicarse garantiza que la información genética se transmita fielmente de una generación celular a otra.
Uno de los avances más importantes fue el desciframiento del código genético: cómo los tripletes de bases del ADN (codones) indican qué aminoácidos formar para construir proteínas. Marshall Nirenberg y Philip Leder lograron identificar esta correspondencia universal. Posteriormente, la técnica de secuenciación desarrollada por Frederick Sanger permitió leer el ADN completo de virus y, más adelante, sentó las bases del Proyecto Genoma Humano.
Gracias a estos avances, hoy la genética se aplica en campos tan diversos como la medicina, la agricultura, la biotecnología o la ecología. Desde el diagnóstico de enfermedades hasta la creación de cultivos más resistentes, el conocimiento del lenguaje de la vida ha transformado nuestra visión del mundo y de nosotros mismos.
Estudiar genética es, en última instancia, comprender cómo se codifica, se transmite y se expresa la información biológica. Es también entender cómo esos mecanismos invisibles influyen en nuestra salud, nuestra evolución y nuestras decisiones tecnológicas y éticas. En un mundo donde la genética está cada vez más presente en la medicina, la agricultura y la biotecnología, su conocimiento se convierte en una herramienta esencial para interpretar el presente y construir el futuro. Es una puerta abierta a los secretos más profundos de la vida y una clave esencial para comprender el presente y diseñar el futuro.
La genética es una de las disciplinas más fascinantes y transformadoras de la biología moderna. Desde los primeros intentos por comprender cómo se transmiten los rasgos de una generación a otra, hasta las tecnologías de edición génica actuales, la genética ha evolucionado de manera vertiginosa, modificando no solo nuestra visión de la vida, sino también el modo en que abordamos la medicina, la agricultura, la evolución, e incluso cuestiones éticas fundamentales.
En el centro de esta ciencia se encuentra un concepto clave: la información biológica se transmite a través de estructuras llamadas genes, que contienen las instrucciones necesarias para construir y hacer funcionar a los seres vivos. Estos genes están codificados en el ADN, una molécula que se encuentra en el núcleo de casi todas las células y que tiene la sorprendente capacidad de copiarse a sí misma, esto es, autorreplicarse y de dirigir la síntesis de proteínas, las verdaderas ejecutoras de las funciones celulares.
Comprender la genética implica mucho más que conocer la estructura del ADN o memorizar leyes de herencia. Es adentrarse en un sistema complejo de regulación, interacción y variación, en el que factores genéticos, ambientales y epigenéticos se entrelazan para dar lugar a la diversidad de formas de vida y a la particularidad de cada individuo.
A lo largo de este estudio abordaremos los fundamentos clásicos de la herencia, como las leyes de Mendel, pero también conceptos más avanzados como la epigenética, la genómica, la genética de poblaciones o la bioética de las tecnologías emergentes. Se trata de una exploración progresiva y estructurada que, sin llegar al nivel técnico más alto, busca ofrecer una comprensión profunda, útil y rigurosa para cualquier lector que desee introducirse en serio en este campo.
Este documento está pensado como una herramienta de aprendizaje y reflexión personal, pero también como un punto de partida para la futura elaboración de contenidos didácticos o divulgativos, que permitan compartir el conocimiento adquirido de forma clara y accesible.
La genética es la rama de la biología que estudia cómo se transmite la información biológica de una generación a otra. Se ocupa de entender qué características heredamos de nuestros progenitores, cómo se organizan esas instrucciones en las células y de qué forma afectan al desarrollo y funcionamiento de los seres vivos.
En el centro de esta disciplina está el concepto de gen, que puede entenderse como una unidad de información codificada en una molécula llamada ADN. Los genes actúan como instrucciones o recetas que permiten a las células fabricar proteínas, las moléculas encargadas de llevar a cabo la mayoría de las funciones del organismo. Desde el color de ojos hasta la predisposición a ciertas enfermedades, muchos rasgos dependen directa o indirectamente de la actividad de los genes.
La genética estudia tanto los mecanismos por los cuales los genes se copian y se transmiten, como las variaciones que pueden surgir durante ese proceso. También investiga cómo se expresan los genes en diferentes tipos de células y en distintos momentos de la vida, y cómo interactúan con el entorno. Es decir, la genética no solo responde a la pregunta de qué heredamos, sino también cómo y por qué.
Con el paso del tiempo, esta ciencia ha dejado de centrarse únicamente en la herencia de rasgos visibles para abarcar temas complejos como la genética molecular, la genética del desarrollo, la epigenética, la genética de poblaciones o la genómica, que estudia el conjunto completo de genes de un organismo. Gracias a los avances en genética, hoy podemos comprender mejor la evolución, prevenir enfermedades hereditarias, diseñar fármacos personalizados y explorar el origen mismo de la vida.
Representación conceptual de la interacción entre la información genética y la investigación biomédica moderna. Imagen: © Por GoldenDayz en Envato.

1.2 Importancia histórica y científica de la genética
La genética ha transformado de forma profunda la historia de la biología y de la ciencia en general. Desde que comenzó a emerger como disciplina a finales del siglo XIX, ha cambiado nuestra manera de entender la vida, el cuerpo humano, la evolución de las especies y la relación entre los seres vivos y su entorno. Lo que comenzó como una curiosidad sobre cómo se heredan los rasgos entre generaciones, se convirtió con el tiempo en uno de los pilares fundamentales de la ciencia moderna.
A nivel histórico, el estudio de la herencia permitió resolver preguntas que habían desconcertado a los pensadores durante siglos: ¿por qué un hijo se parece a su madre?, ¿cómo se transmiten ciertas enfermedades?, ¿por qué algunos rasgos desaparecen y luego reaparecen en generaciones futuras? Las respuestas comenzaron a surgir con los trabajos pioneros de Gregor Mendel, cuyas leyes sobre la herencia de los caracteres en guisantes sentaron las bases de la genética clásica. Sin embargo, su importancia no fue reconocida de inmediato, y solo décadas después se comprendió el alcance de sus descubrimientos.
A lo largo del siglo XX, la genética se fusionó con la biología molecular, dando lugar a una revolución científica. El descubrimiento de la estructura del ADN por Watson y Crick en 1953 permitió explicar cómo se almacena, transmite y copia la información genética. A partir de ahí, la genética se convirtió en una ciencia aplicada a múltiples campos: desde la medicina hasta la agricultura, pasando por la antropología, la biotecnología y la informática. La capacidad de secuenciar, editar e interpretar el genoma ha abierto caminos impensables en la prevención de enfermedades, el desarrollo de terapias personalizadas y la comprensión de la diversidad biológica.
Pero la importancia de la genética no es solo científica: también tiene enormes implicaciones sociales, filosóficas y éticas. La posibilidad de intervenir en los mecanismos más íntimos de la vida plantea dilemas que tocan los límites de lo humano. Cuestiones como la edición genética en embriones, la privacidad de los datos genéticos, o la manipulación de especies generan debates que trascienden la biología y exigen una reflexión colectiva.
Estudiar la genética, por tanto, no es solo comprender cómo funciona el cuerpo o cómo se heredan los rasgos. Es también entender cómo la ciencia puede influir en la sociedad, en la salud pública, en el medio ambiente y en el futuro de la especie humana.
1.3 Conceptos clave y definiciones básicas
Antes de profundizar en los mecanismos de la herencia, es esencial definir con claridad los principales términos que constituyen el lenguaje de la genética. Son conceptos que aparecerán una y otra vez, y cuya comprensión resulta imprescindible para seguir el hilo del estudio.
El primero de ellos es el ADN, o ácido desoxirribonucleico. Se trata de una molécula de gran tamaño, presente en casi todas las células vivas, que almacena la información genética en forma de una secuencia de unidades llamadas nucleótidos. Esa secuencia funciona como un alfabeto biológico que codifica las instrucciones necesarias para el desarrollo y funcionamiento del organismo.
Los fragmentos específicos de ADN que contienen instrucciones concretas reciben el nombre de genes. Cada gen es como una receta: contiene la información para fabricar una proteína determinada. Las proteínas son moléculas esenciales que actúan como enzimas, transportadores, estructuras celulares o señales químicas. Son, en última instancia, las responsables de que las instrucciones codificadas en el ADN se hagan realidad en el cuerpo.
Los genes están organizados dentro de estructuras más grandes llamadas cromosomas, que se localizan en el núcleo de la célula. Cada especie tiene un número determinado de cromosomas; en los seres humanos, por ejemplo, hay 46 cromosomas distribuidos en 23 pares. Uno de cada par procede del padre y otro de la madre. Esta duplicidad es la base de la herencia genética.
A nivel funcional, los genes pueden presentarse en diferentes versiones, llamadas alelos. Por ejemplo, el gen que determina el color de los ojos puede tener un alelo para ojos marrones y otro para ojos azules. Dependiendo de la combinación de alelos que una persona hereda, se manifiestan unos rasgos u otros. A esta combinación de alelos se le llama genotipo, mientras que el resultado visible o medible de esa combinación, como el color de ojos, es el fenotipo.
Otro término clave es el de mutación, que se refiere a cualquier cambio en la secuencia del ADN. Las mutaciones pueden ser naturales o inducidas, beneficiosas, neutras o perjudiciales. Son la base de la variabilidad genética y, por tanto, de la evolución, pero también pueden ser la causa de muchas enfermedades genéticas.
Finalmente, cabe introducir el término genoma, que designa el conjunto completo de material genético de un organismo. La genética clásica se ocupaba del estudio de genes individuales, pero en las últimas décadas ha emergido una nueva rama, llamada genómica, que estudia el genoma en su totalidad, considerando no solo la secuencia de los genes, sino también sus interacciones, su expresión y su regulación.
Estos conceptos básicos forman el vocabulario fundamental con el que trabajaremos a lo largo de todo este estudio. A medida que avancemos, iremos profundizando en ellos y ampliando su significado en contextos más complejos.
Diversidad de rasgos humanos heredados, resultado de variaciones genéticas adaptadas a distintos entornos a lo largo de la historia evolutiva. © Headover-Heels.

La diversidad humana es una de las expresiones más visibles de la herencia genética. Rasgos como el color de la piel, la textura del cabello, la pigmentación de los ojos o la forma de los rasgos faciales son el resultado de la combinación de múltiples genes que interactúan entre sí y responden a la historia evolutiva de cada población. Estas características no aparecen al azar: son el fruto de miles de años de adaptación a distintos climas, niveles de radiación solar, condiciones ambientales y movimientos migratorios que han moldeado la genética de cada región del mundo. El color de la piel, por ejemplo, depende principalmente de la cantidad y el tipo de melanina producida por los melanocitos. Las poblaciones ancestrales que vivían cerca del ecuador desarrollaron niveles elevados de melanina para proteger su ADN de la radiación ultravioleta, mientras que las poblaciones asentadas en latitudes altas redujeron su pigmentación para favorecer la síntesis de vitamina D en ambientes con menor luz solar. Del mismo modo, la forma y textura del cabello, que varía desde rizos apretados hasta hebras lisas y finas, está determinada por factores genéticos que influyen en la curvatura del folículo piloso y que también pueden relacionarse con la temperatura y la humedad de los entornos originales. La diversidad rasgo por rasgo es enorme, pero todos los seres humanos compartimos prácticamente el mismo material genético, con variaciones mínimas que generan una amplia gama de fenotipos posibles. Estas diferencias visibles reflejan la riqueza biológica de la especie humana y subrayan que la variación es una consecuencia natural de la adaptación y la herencia, no una división esencial entre grupos. En el fondo, las diferencias que percibimos con tanta claridad forman parte del mismo hilo evolutivo que une a todas las personas en una historia común.
2. Fundamentos de la herencia genética
Comprender los fundamentos de la herencia genética implica adentrarse en el modo en que se transmiten los rasgos de padres a hijos. Aunque la información genética está codificada en el ADN y almacenada en los genes, no toda la genética trata sobre estructuras microscópicas: también estudia los patrones con los que ciertos caracteres —como el color de ojos, la forma del pelo o la predisposición a ciertas enfermedades— aparecen o se ocultan de una generación a otra.
A partir del trabajo pionero de Gregor Mendel en el siglo XIX, se establecieron leyes básicas que explican cómo se heredan los caracteres. Estas leyes siguen siendo fundamentales hoy, aunque se han ampliado y refinado con el conocimiento actual sobre genética molecular, mutaciones, epigenética y factores ambientales.
Estudiar los principios de la herencia permite entender conceptos esenciales como los alelos, el genotipo, el fenotipo, la dominancia y la recesividad. También nos permite realizar predicciones sobre la probabilidad de que un determinado rasgo se manifieste en la descendencia. En este punto, nos adentraremos en los mecanismos que rigen la transmisión genética, comenzando por los principios mendelianos y avanzando hacia formas más complejas de herencia.
Comprender los fundamentos de la herencia genética implica adentrarse en el modo en que se transmiten los rasgos de padres a hijos. Aunque la información genética está codificada en el ADN y almacenada en los genes, no toda la genética trata sobre estructuras microscópicas: también estudia los patrones con los que ciertos caracteres —como el color de ojos, la forma del pelo o la predisposición a ciertas enfermedades— aparecen o se ocultan de una generación a otra.
A partir del trabajo pionero de Gregor Mendel en el siglo XIX, se establecieron leyes básicas que explican cómo se heredan los caracteres. Estas leyes siguen siendo fundamentales hoy, aunque se han ampliado y refinado con el conocimiento actual sobre genética molecular, mutaciones, epigenética y factores ambientales.
Estudiar los principios de la herencia permite entender conceptos esenciales como los alelos, el genotipo, el fenotipo, la dominancia y la recesividad. También nos permite realizar predicciones sobre la probabilidad de que un determinado rasgo se manifieste en la descendencia. En este punto, nos adentraremos en los mecanismos que rigen la transmisión genética, comenzando por los principios mendelianos y avanzando hacia formas más complejas de herencia.
Aquí comienzan las ampliaciones:
La herencia genética no es solo un mecanismo de transmisión, sino un sistema dinámico en el que la información biológica se conserva, se reordena y, en ocasiones, se transforma. Cada persona recibe dos copias de la mayoría de sus genes: una procedente de la madre y otra del padre. Estas copias pueden ser idénticas o diferentes, y es precisamente esta combinación lo que explica la enorme variabilidad de los rasgos humanos. La interacción entre estas variantes, llamadas alelos, da lugar a múltiples posibilidades fenotípicas que pueden expresarse con mayor o menor intensidad. Algunos alelos dominan sobre otros, imponiendo su efecto, mientras que otros permanecen ocultos durante generaciones hasta que encuentran las condiciones adecuadas para manifestarse.
Los fundamentos de la herencia también abarcan la manera en que los genes se distribuyen durante la formación de los gametos. En la meiosis, los cromosomas se separan y se reorganizan, generando nuevas combinaciones genéticas que nunca habían existido antes. Este proceso de recombinación explica por qué cada hijo es genéticamente único, incluso dentro de una misma familia. En este sentido, la herencia no solo conserva información, sino que también genera diversidad, y esa diversidad es la base de la evolución y la adaptación de las especies.
Pero los principios clásicos no bastan para explicar todos los fenómenos hereditarios. A medida que la genética moderna ha avanzado, hemos comprendido que la expresión de un rasgo no depende únicamente de la presencia de un alelo dominante o recesivo. Muchos caracteres están determinados por múltiples genes que actúan conjuntamente, como ocurre con la estatura, la inteligencia o incluso rasgos tan visibles como el color de la piel. Estos casos se conocen como herencia poligénica y reflejan la complejidad del genoma humano, donde decenas o cientos de genes pueden interactuar para producir un único rasgo observable.
Asimismo, la herencia puede verse modulada por factores que no modifican la secuencia del ADN pero sí influyen en la manera en que se expresan los genes. La epigenética, un campo en plena expansión, ha mostrado que determinadas marcas químicas pueden activar o silenciar genes en respuesta a factores ambientales, experiencias de vida o condiciones fisiológicas. Estas marcas pueden incluso transmitirse a la descendencia, añadiendo una capa adicional de complejidad a los mecanismos hereditarios clásicos.
Todo ello hace que los fundamentos de la herencia genética sean mucho más profundos y ricos de lo que podría parecer desde la perspectiva mendeliana tradicional. Comprenderlos permite no solo interpretar cómo se transmiten los rasgos en una familia, sino también entender la biología evolutiva, los procesos del desarrollo, la aparición de enfermedades genéticas y la interacción constante entre los genes y el ambiente. La herencia es, en definitiva, el puente que une a cada organismo con su pasado, pero también el motor que impulsa su diversidad y su capacidad de adaptación futura.
Modelo didáctico de la doble hélice del ADN, con las bases nitrogenadas A, T, C y G representadas en colores para mostrar la secuencia genética y sus reglas de complementariedad. El ADN o ácido desoxirribonucleico es una estructura de cadenas de doble hélice formada por pares de bases unidos. Chormail ©.

La imagen muestra un modelo didáctico de la molécula de ADN, representada con colores vivos para resaltar la estructura y la disposición de sus componentes fundamentales. Cada una de las piezas alargadas, marcadas con letras como A, T, C o G, corresponde a una de las cuatro bases nitrogenadas que forman el código genético: adenina, timina, citosina y guanina. Estas bases se organizan por pares específicos siguiendo las reglas de complementariedad, de modo que la adenina siempre se une con la timina y la citosina siempre con la guanina. La secuencia en la que aparecen estas bases a lo largo de la molécula constituye la información genética que la célula utiliza para construir proteínas y regular sus funciones internas.
Las tiras laterales que sostienen las bases representan las dos hebras de la doble hélice, formadas por una columna alternada de azúcares y grupos fosfato. Estas hebras se enrollan en espiral y se mantienen unidas gracias a los puentes de hidrógeno que conectan cada par de bases. El modelo a colores simplifica la extraordinaria organización de la molécula real, pero permite comprender de un vistazo cómo la estructura del ADN combina estabilidad y flexibilidad, lo que le permite tanto conservar la información genética como replicarse con precisión durante la división celular. La claridad visual del modelo facilita entender que la información biológica no solo está contenida en los componentes químicos, sino también en la forma en que estos se ordenan y relacionan entre sí.
2.1 Principios básicos de la herencia
Los principios básicos de la herencia genética fueron formulados por Gregor Mendel en el siglo XIX, mucho antes de que se supiera qué eran los genes o el ADN. A través de experimentos meticulosos con plantas de guisante, Mendel identificó patrones repetitivos en la transmisión de ciertos rasgos físicos de una generación a la siguiente. Observó, por ejemplo, que algunos caracteres como la altura de las plantas o el color de las semillas no se mezclaban, sino que se manifestaban de forma clara y predecible, según reglas bien definidas.
Para comprender cómo se transmiten las características biológicas de una generación a otra, es necesario conocer los principios fundamentales que rigen la herencia genética. En primer lugar, es importante entender que cada individuo hereda información genética de sus progenitores en forma de genes, que son segmentos específicos de ADN. Estos genes pueden existir en diferentes versiones llamadas alelos, que ocupan la misma posición (locus) en cromosomas homólogos.
El conjunto de alelos que un organismo posee para un determinado rasgo constituye su genotipo, mientras que la manifestación observable de ese rasgo, como el color de los ojos o la forma de una semilla, se denomina fenotipo. Un genotipo puede estar formado por dos alelos idénticos (homocigoto) o por dos alelos diferentes (heterocigoto).
Los alelos pueden tener una relación de dominancia o recesividad. Un alelo dominante es aquel que se expresa en el fenotipo incluso cuando está presente junto a un alelo diferente. En cambio, un alelo recesivo solo se manifiesta si está presente en ambos cromosomas homólogos, es decir, si no hay un alelo dominante que lo enmascare.
Cuando se cruzan dos individuos, se produce una combinación genética que determina los posibles genotipos y fenotipos de la descendencia. Estas combinaciones pueden predecirse mediante herramientas como los cuadrados o tablas de Punnett, que permiten visualizar cómo se distribuyen los alelos y con qué probabilidad aparece cada rasgo.
Además de la herencia dominante y recesiva, existen otros patrones, como la herencia intermedia (donde ambos alelos se combinan para producir un fenotipo mixto) o la codominancia, en la que ambos alelos se expresan simultáneamente. También hay rasgos determinados por más de un gen (herencia poligénica), así como aquellos influenciados por el ambiente.
Los principios básicos de la herencia explican cómo se transmiten los rasgos de una generación a la siguiente. Gracias a ellos entendemos por qué algunos hijos se parecen a sus padres, abuelos o incluso a otros familiares más lejanos. Todo esto ocurre porque llevamos en nuestras células una “información genética” que hemos heredado.
Esa información está escrita en el ADN y organizada en genes. Cada gen actúa como una pequeña instrucción que define alguna característica: el color de los ojos, la forma de la cara, el grupo sanguíneo, o incluso ciertas enfermedades. Para cada rasgo, recibimos dos copias de cada gen: una del padre y otra de la madre. A esas versiones distintas de un mismo gen se las llama alelos.
Dependiendo de cómo interactúan esos alelos, un rasgo puede expresarse de formas diferentes. Por ejemplo:
- Si un alelo domina sobre el otro, decimos que es dominante, y será el que se exprese.
- Si ambos alelos tienen la misma fuerza, o si ninguno domina por completo, se pueden dar combinaciones distintas, como la herencia intermedia (por ejemplo, una flor roja y una blanca que dan lugar a flores rosadas).
- El conjunto de genes que una persona tiene se llama genotipo, mientras que el conjunto de rasgos que efectivamente se ven se llama fenotipo.
Para predecir cómo se transmitirán ciertos rasgos, los científicos utilizan herramientas como los cuadros de Punnett, que permiten visualizar las posibles combinaciones de genes entre padres e hijos.
En resumen, la herencia se basa en la combinación y expresión de genes que recibimos de nuestros progenitores. Estos principios son la base de toda la genética, y nos ayudan a entender desde los parecidos familiares hasta el origen de muchas enfermedades hereditarias.
Estos principios básicos constituyen la base de la genética mendeliana y sientan las bases para comprender modelos más complejos de transmisión genética en organismos superiores, incluidos los humanos.
Vaina, semillas y flor de Pisum sativum, la planta utilizada por Gregor Mendel para descubrir las leyes fundamentales de la herencia. Sobre esta base experimental que Mendel estableció con los guisantes, pueden entenderse conceptos esenciales como los alelos, el genotipo, el fenotipo y los distintos patrones de herencia. Imagen: © GreensandBlues— Envato Elements.

2.2 Las leyes de Mendel: dominancia, segregación y transmisión independiente
Los experimentos de Gregor Mendel con plantas de guisantes revelaron que la herencia no es un proceso difuso, sino un sistema ordenado que sigue reglas claras. La primera de estas reglas es la ley de la dominancia, que establece que cuando dos variantes distintas de un mismo rasgo se encuentran en un organismo, una de ellas puede imponerse sobre la otra y determinar el aspecto observable.
La segunda es la ley de la segregación, según la cual los alelos que un organismo posee para un determinado carácter se separan durante la formación de los gametos, de modo que cada gameto recibe sólo una de las dos copias. Esta idea explica por qué los rasgos recesivos pueden reaparecer después de una generación en la que habían quedado ocultos.
La tercera ley es la transmisión independiente, que indica que los genes se heredan de manera independiente unos de otros siempre que estén situados en cromosomas distintos. Gracias a esta distribución libre, los descendientes combinan características de formas nuevas, lo que aumenta la variabilidad genética y permite observar patrones de herencia variados en cada cruce.
Los experimentos de Gregor Mendel con plantas de guisantes revelaron que la herencia no es un proceso difuso, sino un sistema ordenado que sigue reglas claras. La primera de estas reglas es la ley de la dominancia, que establece que cuando dos variantes distintas de un mismo rasgo se encuentran en un organismo, una de ellas puede imponerse sobre la otra y determinar el aspecto observable.
La segunda es la ley de la segregación, según la cual los alelos que un organismo posee para un determinado carácter se separan durante la formación de los gametos, de modo que cada gameto recibe sólo una de las dos copias. Esta idea explica por qué los rasgos recesivos pueden reaparecer después de una generación en la que habían quedado ocultos.
La tercera ley es la transmisión independiente, que indica que los genes se heredan de manera independiente unos de otros siempre que estén situados en cromosomas distintos. Gracias a esta distribución libre, los descendientes combinan características de formas nuevas, lo que aumenta la variabilidad genética y permite observar patrones de herencia variados en cada cruce. Los grupos sanguíneos permiten explicar de forma visual:
qué son los alelos,
cómo se combinan en un genotipo,
cómo se expresan en fenotipos distintos,
y cómo funcionan la dominancia, la recesividad y la codominancia.
Todo ello sin sobrecargar con fórmulas o cuadros, pero manteniendo una base científica sólida y comprensible incluso para lectores sin formación técnica.
Aquí comienza la expansión enriquecida:
El trabajo de Mendel marcó un antes y un después porque demostró que la herencia podía estudiarse de manera cuantitativa. Sus leyes describen patrones que, décadas después, se confirmaron mediante el estudio del ADN, dando lugar a la genética moderna. La ley de la dominancia no solo explica por qué ciertos rasgos se manifiestan con mayor frecuencia, sino también por qué existe una jerarquía funcional entre alelos. Esta dominancia no implica que un alelo sea “mejor” o “más fuerte”, sino simplemente que su producto biológico prevalece sobre el del otro en la expresión del rasgo. En algunos caracteres esta dominancia es completa, mientras que en otros aparece de manera parcial, como ocurre en la herencia intermedia del color de ciertas flores o en características humanas como algunos tonos de piel o textura del cabello.
La ley de la segregación introduce un concepto clave: cada individuo lleva dos copias de cada gen, pero solo transmite una. Esta separación ordenada durante la meiosis no solo es la base de los cálculos mendelianos clásicos, sino también de la enorme variabilidad entre hermanos. Cuando la combinación aleatoria de gametos reúne dos alelos distintos, emerge un fenotipo que puede coincidir o no con el de los progenitores, y que en ocasiones puede reavivar rasgos que parecían perdidos en la historia familiar. Es un recordatorio de que la herencia opera como una red de posibilidades en la que el azar y la biología participan conjuntamente.
La tercera ley, la de transmisión independiente, amplía la comprensión de la diversidad genética. Cuando genes situados en diferentes cromosomas se distribuyen de manera independiente, sus combinaciones posibles se multiplican de forma exponencial. Este fenómeno explica por qué rasgos como el color de ojos, la forma de la cara o ciertos aspectos de la personalidad pueden mezclarse de maneras sorprendentemente variadas entre descendientes de los mismos padres. Aunque actualmente se sabe que algunos genes tienden a heredarse juntos porque están físicamente próximos en el mismo cromosoma —lo que se conoce como ligamiento—, el principio general de la transmisión independiente sigue siendo esencial para entender cómo la recombinación genética genera novedad biológica en cada generación.
Las leyes de Mendel, aunque formuladas hace más de 150 años, continúan siendo un pilar conceptual porque permiten entender patrones de herencia simples y también sirven como punto de partida para estudiar formas más complejas de transmisión, como la herencia poligénica, la codominancia o la influencia del ambiente en la expresión génica. Gracias a ellas, la genética adquirió estructura, lenguaje y método, y se convirtió en una ciencia capaz de interpretar tanto los rasgos cotidianos como las bases moleculares de enfermedades hereditarias. Mendel no solo descubrió cómo se heredan los caracteres; reveló la lógica oculta que sostiene la continuidad de la vida.
Los grupos sanguíneos permiten explicar de forma visual:
qué son los alelos,
cómo se combinan en un genotipo,
cómo se expresan en fenotipos distintos,
y cómo funcionan la dominancia, la recesividad y la codominancia.
Todo ello sin sobrecargar con fórmulas o cuadros, pero manteniendo una base científica sólida y comprensible incluso para lectores sin formación técnica.
Compatibilidad de grupos sanguíneos (sistema ABO). © Noteomg – Envato Elements.

🧬 Anexo: Los grupos sanguíneos como ejemplo perfecto de herencia mendeliana extendida
Uno de los ejemplos más claros y cotidianos para comprender cómo funcionan los alelos, el genotipo y el fenotipo es el sistema de grupos sanguíneos ABO. Aunque Mendel trabajó con guisantes, el principio es el mismo: cada rasgo está determinado por alelos que se combinan para producir un resultado observable.
En el caso de la sangre humana, el gen que determina el grupo sanguíneo tiene tres alelos posibles:
A
B
O
Cada persona posee dos alelos, uno procedente de cada progenitor. Estas combinaciones forman el genotipo, y según cómo interactúan entre sí producen un fenotipo, es decir, el grupo sanguíneo observable:
A + A → grupo A
A + O → grupo A
B + B → grupo B
B + O → grupo B
A + B → grupo AB
O + O → grupo O
Lo interesante de este sistema es que en él se manifiestan varios conceptos fundamentales de la genética:
✔ Herencia dominante y recesiva
Los alelos A y B son dominantes sobre O, que es recesivo.
Por eso un genotipo AO o BO da como fenotipo A o B, no O.
✔ Codominancia
A diferencia de los rasgos mendelianos simples, los alelos A y B son codominantes.
Esto significa que cuando ambos están presentes (genotipo AB), los dos se expresan simultáneamente, dando lugar al grupo sanguíneo AB.
✔ Alelo múltiple
Mientras que Mendel describió rasgos con solo dos variantes, el sistema ABO muestra que algunos genes tienen más de dos alelos posibles, ampliando la variedad de combinaciones.
✔ Compatibilidad sanguínea como expresión del fenotipo
La imagen del diagrama de donante y receptor refleja cómo estas combinaciones genéticas se traducen en una consecuencia práctica: quién puede donar o recibir sangre. Esta compatibilidad no es arbitraria, sino una manifestación directa de la interacción entre los alelos.
2.3 Alelos, genotipo y fenotipo
Cada rasgo hereditario se encuentra codificado por genes que pueden presentarse en diversas versiones, conocidas como alelos. Estas variantes ocupan el mismo lugar en los cromosomas homólogos, pero pueden influir de manera distinta en la manifestación del rasgo.
El genotipo es el conjunto de alelos que posee un organismo para un determinado carácter, mientras que el fenotipo es la expresión visible o medible de esos alelos. De este modo, dos individuos pueden compartir un mismo fenotipo aun teniendo genotipos diferentes, dependiendo de cómo interactúen sus alelos y de cómo se expresen.
Comprender la herencia genética exige distinguir entre los elementos que forman la base de la variabilidad y los que hacen visibles sus efectos. Los alelos son versiones alternativas de un mismo gen que pueden diferir ligeramente en su secuencia y, por tanto, en la forma en que influyen en un rasgo. Estas variaciones pueden ser tan sutiles como un único cambio en una base nitrogenada o tan amplias como una modificación estructural más extensa; sin embargo, basta a veces una mínima diferencia para alterar de forma notable el resultado final. Cada individuo recibe dos alelos para la mayoría de sus genes, uno de cada progenitor, y la interacción entre ambos define la base genética que determinará cómo se manifestará el rasgo correspondiente.
La combinación específica de alelos que posee un organismo para un determinado carácter constituye su genotipo. Este genotipo no es simplemente una etiqueta molecular, sino un conjunto complejo de instrucciones que interactúan, se ajustan y responden al entorno celular. Aunque los genes establecen el potencial hereditario, ese potencial no se materializa automáticamente; su manifestación depende de la regulación de la expresión génica, del ambiente, de la epigenética y de otros factores intermedios que transforman la información genética en características observables.
El fenotipo, por su parte, es la expresión concreta de ese genotipo en un organismo determinado. Incluye rasgos visibles, como el color de los ojos o la estatura, pero también características internas que no se perciben a simple vista, como el grupo sanguíneo, la respuesta inmunitaria o la actividad metabólica. El fenotipo no es únicamente la consecuencia directa del genotipo, sino el resultado final de un diálogo continuo entre los genes y el entorno. Incluso individuos con genotipos idénticos, como los gemelos monocigóticos, pueden mostrar diferencias fenotípicas a lo largo de su vida, recordándonos que la biología no es un determinismo rígido, sino un espacio dinámico donde la genética y el ambiente interactúan constantemente.
La relación entre genotipo y fenotipo no siempre es sencilla. En algunos casos, un solo gen determina un rasgo de manera clara, como ocurre con ciertas enfermedades mendelianas. Sin embargo, la mayoría de los rasgos humanos tienen un origen poligénico, es decir, están controlados por la acción conjunta de múltiples genes, cada uno con una contribución pequeña pero significativa. Esto explica por qué rasgos como la inteligencia, el color de la piel o la estatura muestran una amplia gradación en la población y no categorías estrictamente definidas. La presencia de múltiples alelos, junto con factores ambientales y epigenéticos, añade capas de complejidad que hacen que el fenotipo sea un fenómeno más rico y variado de lo que la simple mezcla de alelos podría sugerir.
En definitiva, los alelos proporcionan las variantes heredadas, el genotipo organiza esas variantes en combinaciones únicas y el fenotipo las materializa en rasgos observables. Juntos conforman el núcleo de la herencia genética y explican por qué cada persona es, al mismo tiempo, fruto de una historia biológica familiar y una expresión irrepetible de su propio desarrollo.
2.4 Herencia dominante, recesiva e intermedia
Cuando un individuo recibe dos alelos distintos para un mismo gen, la forma en que se combinan determina el tipo de herencia. En la herencia dominante, basta con que uno de los alelos sea dominante para que su efecto se exprese, incluso si el otro es recesivo.
En la herencia recesiva, el rasgo sólo aparece cuando ambas copias son iguales y no hay un alelo dominante que lo oculte.
Existen también formas de herencia más matizadas. La dominancia incompleta o herencia intermedia aparece cuando ninguno de los dos alelos domina por completo, de modo que el fenotipo resultante es un término medio entre ambos. Este tipo de interacción muestra que la transmisión genética puede adoptar formas flexibles y no siempre responde a patrones estrictos.
La forma en que los alelos interactúan para determinar un rasgo es uno de los aspectos más fascinantes y diversos de la genética. Aunque Mendel describió inicialmente la dominancia y la recesividad como reglas claras, hoy sabemos que las relaciones entre alelos forman un espectro más amplio y matizado. La dominancia no es un fenómeno absoluto, sino una forma particular de interacción entre variantes que se manifiesta de distintas maneras según el gen, el contexto celular e incluso factores ambientales.
En la herencia dominante, basta con que un individuo posea una sola copia de un alelo determinado para que el rasgo asociado se exprese en el fenotipo. El alelo dominante no “silencia” al recesivo en un sentido literal, sino que produce un efecto biológico que resulta suficiente para determinar la característica observable. Este tipo de herencia explica por qué ciertos rasgos, como algunos tipos de pelo oscuro o ciertas enfermedades hereditarias dominantes, aparecen en cada generación con relativa frecuencia. La presencia de un alelo dominante garantiza su expresión incluso cuando la otra copia heredada es distinta.
Por el contrario, la herencia recesiva requiere la presencia de dos copias idénticas del alelo correspondiente para que el rasgo se manifieste. Un individuo que porta solo una copia recesiva no expresa el rasgo, pero puede transmitirlo a su descendencia. Este patrón explica por qué muchas características recesivas parecen “saltar” generaciones o reaparecer inesperadamente en hijos cuyos padres no presentan el rasgo de forma visible. Las enfermedades genéticas recesivas suelen mantenerse ocultas en la población, transmitidas silenciosamente de generación en generación hasta que dos portadores coinciden y existe la posibilidad de que un hijo herede ambas copias recesivas.
Sin embargo, entre la dominancia completa y la recesividad estricta existe una gama intermedia de posibilidades. La herencia intermedia, también llamada dominancia incompleta, aparece cuando ninguno de los alelos es capaz de imponerse totalmente al otro. El resultado es un fenotipo que representa un punto intermedio entre ambos. Un ejemplo clásico es el color de ciertas flores que, al cruzarse, generan individuos con tonalidades intermedias. En humanos, algunos rasgos físicos y ciertas condiciones bioquímicas se aproximan a este patrón, donde la mezcla de alelos produce una característica que refleja parcialmente la contribución de ambos.
Otra variante relacionada, aunque distinta, es la codominancia, en la que ambos alelos se expresan simultáneamente sin que ninguno domine sobre el otro. Los grupos sanguíneos del sistema ABO son el ejemplo por excelencia: un individuo con alelos A y B expresa ambos antígenos al mismo tiempo, dando lugar al grupo AB. Este tipo de herencia subraya que la dominancia no es un fenómeno jerárquico, sino una cuestión de interacción funcional entre productos génicos.
La comprensión de estas distintas formas de herencia permite interpretar con claridad cómo se manifiestan los rasgos y por qué la variabilidad genética es tan amplia incluso dentro de una misma familia. También muestra que la genética no opera mediante reglas rígidas, sino mediante relaciones flexibles que responden a la naturaleza del gen y a las funciones que desempeña en el organismo. Estos patrones de dominancia, recesividad e intermedia conforman la base con la que los genes se expresan y se combinan, dando lugar a la diversidad fenotípica que caracteriza a la especie humana.
2.5 Ejemplos prácticos de cruces genéticos (tablas de Punnett)
Las tablas de Punnett son una herramienta clásica para representar cómo se combinan los alelos de los progenitores y para prever las proporciones genotípicas y fenotípicas de la descendencia. Si se cruza una planta homocigótica dominante con otra homocigótica recesiva, todas las plantas hijas compartirán el mismo genotipo heterocigótico y expresarán el rasgo dominante. En un cruce entre dos individuos heterocigóticos, las combinaciones posibles se distribuyen de forma característica: una proporción 1:2:1 en los genotipos y aproximadamente un 3:1 en los fenotipos, con un individuo mostrando el rasgo recesivo por cada tres que expresan el dominante.
Estos ejemplos, sencillos pero poderosos, permiten visualizar la lógica interna de la herencia y son la base del estudio moderno de la genética.
Las tablas de Punnett constituyen una herramienta sencilla y a la vez poderosa para visualizar cómo se combinan los alelos de dos progenitores y qué probabilidades existen de que la descendencia exprese determinados rasgos. Aunque su apariencia es simple —una cuadrícula que cruza los gametos de cada progenitor—, su utilidad reside en que permite traducir la herencia genética a un lenguaje claro, casi gráfico, en el que las posibilidades se ordenan ante nuestros ojos. Gracias a ellas, conceptos como genotipo, fenotipo, dominancia, recesividad o portador adquieren una dimensión concreta y comprensible.
Imaginemos un cruce sencillo entre dos individuos heterocigotos para un rasgo recesivo, por ejemplo el color de la flor en las plantas estudiadas por Mendel. Si ambos padres poseen un alelo dominante y un alelo recesivo, la tabla de Punnett muestra las cuatro combinaciones posibles de estos alelos en la descendencia. De esta forma podemos ver que existe una probabilidad del cincuenta por ciento de que los hijos hereden al menos un alelo dominante y manifiesten el rasgo dominante, un veinticinco por ciento de que sean heterocigotos como sus padres y un veinticinco por ciento de que hereden dos copias recesivas y expresen el rasgo recesivo. Esta visualización simple permite comprender, de un vistazo, fenómenos como la reaparición de rasgos ocultos o la presencia de portadores que no manifiestan la característica pero la transmiten a sus hijos.
Las tablas de Punnett también permiten ilustrar casos más complejos, como la codominancia o la dominancia incompleta. En los grupos sanguíneos del sistema ABO, por ejemplo, los alelos A y B son codominantes, mientras que el alelo O es recesivo. Un cruce entre un individuo con genotipo AO y otro con genotipo BO puede dar lugar a hijos con cuatro posibles grupos sanguíneos: A, B, AB u O. La tabla de Punnett ayuda a mostrar cómo esta diversidad surge de la interacción simultánea de alelos dominantes y recesivos que se expresan de formas distintas. Estos ejemplos revelan que los patrones hereditarios rara vez se ajustan a simplificaciones absolutas; más bien, reflejan la complejidad real del genoma.
Incluso en rasgos poligénicos, donde intervienen muchos genes a la vez y donde las tablas de Punnett pierden su simplicidad clásica, su lógica sigue resultando útil para comprender cómo la variación se acumula. Aunque no se puedan representar todas las combinaciones en una sola cuadrícula, la idea fundamental sigue siendo la misma: cada progenitor aporta un número determinado de variantes, y las combinaciones posibles generan un amplio espectro fenotípico. Esta noción es esencial para interpretar por qué rasgos como la estatura, el tono de piel o la forma del rostro muestran gradaciones continuas en la población.
Las tablas de Punnett no son solo un recurso pedagógico, sino una puerta de entrada al pensamiento genético. Permiten visualizar con claridad la idea de probabilidad, que es central en toda la herencia. Tener un veinticinco por ciento de probabilidad no garantiza un resultado concreto, pero sí describe el marco general en el que operan los procesos biológicos. Esta perspectiva probabilística ayuda a comprender por qué hermanos con los mismos padres pueden diferir tanto entre sí y por qué ciertos rasgos familiares no se manifiestan en todas las generaciones.
En conjunto, estos ejemplos prácticos demuestran que la herencia es un proceso ordenado y comprensible, pero también lleno de matices. Las tablas de Punnett ofrecen un modo accesible de entrar en esa complejidad, mostrando cómo combinaciones simples pueden dar lugar a una extraordinaria diversidad biológica. Gracias a ellas, la genética deja de ser un abstracto juego de alelos y se convierte en un mapa visual que explica cómo la vida transmite su información de una generación a la siguiente.
El abuelo y el nieto de una familia indígena posan delante con su traje tradicional. © Albertolopezphoto.

La imagen retrata algo más profundo que una escena cotidiana entre un anciano indígena y un niño: muestra, de forma silenciosa pero poderosa, la continuidad de una herencia humana que no es sólo genética, sino también cultural, histórica y adaptativa. Ambos cuerpos, ambos rostros y ambos gestos contienen siglos de evolución, selección y transmisión, no sólo de rasgos físicos, sino también de formas de entender y sobrevivir en el mundo. La antropología cultural y la arqueología coinciden en que ningún rasgo aparece o persiste por azar; todo lo que llega hasta nosotros lo hace porque, en algún momento del pasado, ofreció una ventaja, una adaptación o una forma de vida posible en condiciones duras, cambiantes y a menudo implacables.
Los rasgos físicos de estos pueblos indígenas —la pigmentación de la piel, la estructura ósea, la forma del cabello o la resistencia fisiológica a determinados climas o altitudes— son la huella directa de la selección natural actuando durante miles de años. En entornos donde el sol era intenso, la piel oscura protegía contra la radiación; en zonas de elevada altitud, los pulmones y la sangre evolucionaron para transportar más oxígeno; en climas fríos o húmedos, otras características corporales resultaron más eficientes. La arqueología demuestra que estas adaptaciones no fueron estáticas: variaron con las migraciones, las presiones ambientales y los contactos entre pueblos, desapareciendo algunas líneas genéticas y consolidándose otras que hicieron posible la supervivencia. Lo que hoy vemos en el rostro del niño es el resultado de un filtro riguroso que la naturaleza aplicó durante generaciones.
Pero los rasgos que perduran no son únicamente biológicos. La antropología cultural muestra que también sobreviven los rasgos intelectuales, los saberes acumulados, las estrategias de vida y las formas de pensamiento que permitieron a un grupo adaptarse a su medio. La manera de interpretar el paisaje, el conocimiento sobre las plantas, las tradiciones artesanales, la organización social y los rituales son, igual que los genes, herramientas de supervivencia transmitidas de ancianos a niños. En este sentido, la cultura se comporta como un segundo sistema hereditario: se selecciona, se transforma y se preserva aquello que favorece la supervivencia del grupo. Un gesto del anciano, un objeto ritual o una simple enseñanza transmitida con palabras pueden ser tan importantes para la continuidad de un pueblo como la transmisión de los alelos que determinan el color de su piel.
La arqueología revela cómo estas dos formas de herencia —biológica y cultural— han avanzado entrelazadas a lo largo del tiempo. Las poblaciones que persistieron fueron aquellas capaces de integrar su fisiología con un sistema de conocimientos adaptado a su entorno. En consecuencia, muchos rasgos “desaparecidos” no se extinguieron por debilidad, sino porque ya no ofrecían una ventaja adaptativa en condiciones nuevas. Lo que queda, lo que vemos en la imagen, es la combinación de cuerpos moldeados por la naturaleza y mentes moldeadas por generaciones de experiencia acumulada. Es una supervivencia doble: la del organismo y la de la memoria colectiva.
En el rostro del anciano hay miles de años de selección natural y selección cultural. En el rostro del niño, miles de años más por venir. Juntos representan el flujo continuo de la humanidad: un puente entre lo que fuimos, lo que somos y lo que podemos seguir siendo si mantenemos viva la sabiduría que nos permitió sobrevivir a un mundo siempre hostil y siempre cambiante.
3. La estructura y función de los genes
Tras haber comprendido cómo se transmiten los rasgos de padres a hijos, es fundamental entender qué son exactamente los genes, cómo están organizados en las células y qué función desempeñan en el organismo. Esta sección se adentra en la base molecular de la herencia: el ADN, los genes, los cromosomas, y la relación directa entre la información genética y la producción de proteínas, que son los elementos funcionales y estructurales de la vida.
Comprender cómo se almacena, organiza y utiliza la información genétic es clave para entender desde los procesos más simples del desarrollo embrionario hasta las enfermedades genéticas más complejas. La genética moderna se apoya en los descubrimientos realizados en biología molecular, y esta sección sienta las bases para comprenderlos.
Tras haber comprendido cómo se transmiten los rasgos de padres a hijos, es fundamental entender qué son exactamente los genes, cómo están organizados en las células y qué función desempeñan en el organismo. Esta sección se adentra en la base molecular de la herencia: el ADN, los genes, los cromosomas, y la relación directa entre la información genética y la producción de proteínas, que son los elementos funcionales y estructurales de la vida.
Comprender cómo se almacena, organiza y utiliza la información genética es clave para entender desde los procesos más simples del desarrollo embrionario hasta las enfermedades genéticas más complejas. La genética moderna se apoya en los descubrimientos realizados en biología molecular, y esta sección sienta las bases para comprenderlos.
A este nivel molecular, el ADN no es solo un depósito estático de información, sino un sistema extraordinariamente dinámico. Sus secuencias se enrollan, se repliegan, se abren y se cierran según las necesidades de la célula, permitiendo que ciertos genes se activen en momentos precisos y que otros permanezcan silenciosos. Esta capacidad de modular la información almacenada explica por qué células con un ADN idéntico pueden desempeñar funciones completamente distintas en el organismo. Cada célula “lee” únicamente aquellas instrucciones que necesita, como si dentro de un libro inmenso escogiera solo los capítulos relevantes para su tarea.
Los genes, por tanto, no son entidades aisladas: forman redes, interactúan entre sí y responden al entorno interno y externo. La célula interpreta estas instrucciones mediante un lenguaje químico finísimo, convirtiendo secuencias de bases en proteínas que construyen tejidos, regulan reacciones metabólicas y permiten la comunicación entre órganos y sistemas. Esta relación íntima entre estructura genética y función biológica es uno de los pilares que sostiene toda la organización de la vida.
Del mismo modo, los cromosomas no deben verse únicamente como soportes físicos del ADN, sino como auténticas unidades de empaquetamiento y regulación. Su organización tridimensional dentro del núcleo es esencial para decidir qué genes pueden expresarse y cuáles deben mantenerse inactivos. La genética contemporánea ha demostrado que la posición de un gen dentro del cromosoma, e incluso la posición del cromosoma dentro del núcleo, influye en su actividad. La herencia biológica no es solo cuestión de secuencias, sino también de arquitectura interna.
En conjunto, esta visión ampliada de los genes nos permite comprender que la vida se sostiene en un equilibrio delicado entre estabilidad y cambio: estabilidad para preservar la información que ha permitido sobrevivir a generaciones anteriores, y cambio para adaptarse a un entorno que nunca permanece igual. Estudiar la estructura y función de los genes es, en esencia, adentrarse en el corazón mismo de ese equilibrio.
3.1 ¿Qué es un gen?
Un gen es una unidad de información hereditaria. Más específicamente, es un segmento de ADN que contiene la información necesaria para fabricar una molécula funcional, generalmente una proteína. Las proteínas, a su vez, son esenciales para que las células funcionen correctamente: actúan como enzimas que catalizan reacciones químicas, como hormonas que envían señales, o como componentes estructurales que forman parte de músculos, piel, cabello, entre muchos otros ejemplos.
El ADN (ácido desoxirribonucleico) está formado por una secuencia de cuatro bases nitrogenadas (adenina, timina, citosina y guanina), que se ordenan en una secuencia específica como si fueran letras formando palabras. Cada gen está formado por una parte de esa secuencia, y la combinación concreta de esas letras es lo que determina qué proteína se produce y cómo se construye.
En los seres humanos, se estima que existen entre 20.000 y 25.000 genes, distribuidos a lo largo de 23 pares de cromosomas. Cada célula del cuerpo (excepto las reproductoras) contiene una copia completa de todo este material genético, aunque no todos los genes están activos al mismo tiempo ni en todas las células.
Además, no todos los genes codifican proteínas. Existen genes reguladores que no fabrican proteínas directamente, pero que controlan cuándo y cómo se activan otros genes. Esta función reguladora es fundamental para que cada célula se especialice y cumpla su función dentro del cuerpo.
En resumen, los genes son fragmentos de ADN que contienen las instrucciones para construir las proteínas necesarias para la vida. Son los verdaderos «párrafos» del libro de la vida, y su correcta interpretación y funcionamiento son esenciales para la salud, el desarrollo y el mantenimiento de los organismos.
Un gen es una unidad de información hereditaria. Más específicamente, es un segmento de ADN que contiene la información necesaria para fabricar una molécula funcional, generalmente una proteína. Las proteínas, a su vez, son esenciales para que las células funcionen correctamente: actúan como enzimas que catalizan reacciones químicas, como hormonas que envían señales, o como componentes estructurales que forman parte de músculos, piel, cabello, entre muchos otros ejemplos.
El ADN (ácido desoxirribonucleico) está formado por una secuencia de cuatro bases nitrogenadas (adenina, timina, citosina y guanina), que se ordenan en una secuencia específica como si fueran letras formando palabras. Cada gen está formado por una parte de esa secuencia, y la combinación concreta de esas letras es lo que determina qué proteína se produce y cómo se construye.
En los seres humanos, se estima que existen entre 20.000 y 25.000 genes, distribuidos a lo largo de 23 pares de cromosomas. Cada célula del cuerpo (excepto las reproductoras) contiene una copia completa de todo este material genético, aunque no todos los genes están activos al mismo tiempo ni en todas las células.
Además, no todos los genes codifican proteínas. Existen genes reguladores que no fabrican proteínas directamente, pero que controlan cuándo y cómo se activan otros genes. Esta función reguladora es fundamental para que cada célula se especialice y cumpla su función dentro del cuerpo.
En resumen, los genes son fragmentos de ADN que contienen las instrucciones para construir las proteínas necesarias para la vida. Son los verdaderos “párrafos” del libro de la vida, y su correcta interpretación y funcionamiento son esenciales para la salud, el desarrollo y el mantenimiento de los organismos.
A este concepto básico se suma un aspecto especialmente fascinante: los genes no actúan de manera aislada, sino en redes complejas que dialogan entre sí. La célula interpreta simultáneamente miles de instrucciones procedentes de distintos genes, ajustando la producción de proteínas según las necesidades del momento. Esta interacción es tan precisa que pequeñas variaciones en la secuencia —una sola letra cambiada— pueden hacer que la célula fabrique una proteína distinta, más eficiente, menos estable o incluso dañina. La genética moderna ha revelado que algunas de estas variaciones no solo determinan rasgos visibles, como el color de ojos o la forma del cabello, sino que también influyen en la susceptibilidad a enfermedades, en la respuesta a medicamentos o en la capacidad de adaptación de una población a su entorno.
Asimismo, comprender qué es un gen implica reconocer que la información hereditaria no se limita únicamente al ADN nuclear. Las mitocondrias, pequeñas estructuras dentro de las células encargadas de producir energía, poseen su propio ADN, heredado exclusivamente por vía materna. Este detalle añade un matiz evolutivo y antropológico adicional, pues permite reconstruir linajes maternos y rastrear migraciones ancestrales de los pueblos.
El estudio de los genes también revela la elegancia del equilibrio evolutivo: demasiada variación puede resultar perjudicial, pero muy poca limita la adaptación al entorno. La existencia de versiones alternativas de un mismo gen —los alelos— permite que una población disponga de un repertorio variado de respuestas biológicas, proporcionando la flexibilidad necesaria para enfrentar cambios ambientales, nuevas enfermedades o presiones selectivas inesperadas.
Así, un gen no es simplemente una sección de ADN. Es una unidad viva de significado biológico, un fragmento del lenguaje molecular con el que se escribe la historia de todas las especies, incluyéndonos a nosotros. Comprender su naturaleza es comprender, en gran medida, qué nos hace ser quienes somos.
3.2 Composición química del ADN: estructura de la doble hélice
El ADN (ácido desoxirribonucleico) es la molécula que contiene la información genética de todos los seres vivos. Su estructura fue descrita en 1953 por James Watson y Francis Crick, a partir de los datos experimentales obtenidos por Rosalind Franklin mediante técnicas de difracción de rayos X. Esta estructura permitió entender cómo se almacena y se copia la información genética.
La estructura del ADN es una de las mayores revelaciones científicas del siglo XX, no sólo por su elegancia, sino porque explica de manera directa cómo la vida puede almacenar, copiar y transmitir información a lo largo de las generaciones. El ADN adopta la forma de una doble hélice, una estructura en espiral formada por dos cadenas complementarias que se enrollan una alrededor de la otra como los peldaños de una escalera retorcida. Esta forma no es un simple capricho geométrico: es la base de su estabilidad, su eficiencia y su extraordinaria capacidad para conservar la información genética con precisión.
Cada una de las dos hebras está formada por una columna vertebral compuesta de azúcar (desoxirribosa) y grupos fosfato. Esta columna se mantiene rígida y estable, protegiendo el contenido más valioso, que se encuentra en el interior: las bases nitrogenadas. Estas bases —adenina, timina, citosina y guanina— son los “caracteres” del alfabeto genético. Se emparejan siempre del mismo modo, siguiendo las reglas de la complementariedad: la adenina se une con la timina, mientras que la citosina se une con la guanina. Esta unión precisa asegura que la molécula pueda copiarse con fiabilidad, ya que cada hebra sirve como molde para construir su complemento.
La disposición de estas bases en una secuencia concreta determina la información genética que contiene cada fragmento del ADN. A una escala microscópica, la doble hélice no permanece quieta: se abre, se cierra, se torsiona y permite el acceso temporal de proteínas que leen, copian o reparan su contenido. Esta dinámica convierte al ADN en un libro vivo, cuya lectura está regulada por la propia célula según sus necesidades. Así, la estructura tridimensional no solo organiza el código genético, sino que también influye en cuándo y cómo los genes pueden activarse.
Además, el ADN no se encuentra libre dentro de la célula, sino firmemente asociado a proteínas llamadas histonas, alrededor de las cuales se enrolla formando unidades compactas conocidas como nucleosomas. Esta organización es esencial para empaquetar enormes cantidades de información en un espacio reducido, pero también cumple una función reguladora: según cuán apretada o relajada esté la hélice, ciertos genes pueden quedar accesibles o inaccesibles, facilitando o impidiendo su expresión.
La estructura del ADN, por tanto, no debe entenderse únicamente como un soporte físico. Es un diseño perfectamente adaptado para permitir la conservación de la información, su transmisión entre generaciones, su copia durante la división celular y la activación selectiva de genes que define el funcionamiento de cada tipo de célula. Es, en definitiva, el andamiaje donde la vida ha escrito su historia y sobre el cual continúa construyéndose generación tras generación.
¿Cómo está compuesto el ADN?
El ADN está formado por tres elementos principales:
- Un grupo fosfato
- Un azúcar de cinco carbonos, llamado desoxirribosa
- Una base nitrogenada, que puede ser:
- Adenina (A)
- Timina (T)
- Citosina (C)
- Guanina (G)
Estas tres partes forman lo que se llama un nucleótido, que es la unidad básica del ADN. Los nucleótidos se enlazan entre sí formando una cadena larga, similar a un collar de cuentas, donde las cuentas serían los nucleótidos.
La doble hélice
El ADN no es una simple cadena lineal, sino que está formado por dos cadenas complementarias que se enrollan en forma de hélice, como una escalera de caracol. Las bases nitrogenadas de una cadena se emparejan con las bases de la otra mediante enlaces de hidrógeno. Este emparejamiento sigue reglas muy precisas:
- La adenina (A) siempre se une con la timina (T)
- La citosina (C) siempre se une con la guanina (G)
Este emparejamiento se llama complementariedad de bases, y es fundamental para que el ADN pueda autorreplicarse, es decir, copiarse a sí mismo durante la división celular.
Importancia de la estructura
La doble hélice no solo permite que la información genética esté protegida y bien organizada, sino que también facilita su copia fiel. Cuando una célula se divide, las dos cadenas del ADN se separan, y cada una sirve de molde para formar una nueva cadena complementaria. Así, se garantiza que las nuevas células reciban una copia exacta del ADN original.
En resumen, el ADN es una molécula con una estructura elegante y eficiente: una doble hélice formada por cadenas de nucleótidos, que guarda las instrucciones necesarias para construir y mantener un ser vivo. Su estabilidad, capacidad de copia y codificación de información lo convierten en el soporte perfecto para la herencia biológica.
3.3 Diferencias entre ADN y ARN
El ADN (ácido desoxirribonucleico) y el ARN (ácido ribonucleico) son dos tipos de ácidos nucleicos fundamentales para el funcionamiento de los seres vivos. Aunque ambos están formados por cadenas de nucleótidos y contienen información genética, tienen funciones distintas y diferencias clave en su estructura química.
a. Azúcar del nucleótido
La principal diferencia química entre ambos radica en el tipo de azúcar que contienen:
- El ADN contiene desoxirribosa, un azúcar que carece de un átomo de oxígeno en uno de sus carbonos.
- El ARN contiene ribosa, que sí posee ese átomo de oxígeno.
Este pequeño cambio hace que el ARN sea más reactivo y menos estable que el ADN.
b. Número de cadenas
- El ADN está formado por dos cadenas que se enrollan formando la doble hélice.
- El ARN es usualmente una cadena sencilla (monocatenaria), aunque puede adoptar estructuras secundarias al plegarse sobre sí misma.
c. Bases nitrogenadas
Ambas moléculas comparten tres bases: adenina (A), citosina (C) y guanina (G). Pero difieren en una:
- El ADN utiliza timina (T).
- El ARN reemplaza la timina por uracilo (U).
Así, en el ARN, la adenina se empareja con uracilo en lugar de con timina.
d. Ubicación celular
- El ADN se encuentra principalmente en el núcleo de las células eucariotas (aunque también está presente en mitocondrias y cloroplastos).
- El ARN puede salir del núcleo y se encuentra tanto en el núcleo como en el citoplasma, ya que participa activamente en la síntesis de proteínas.
e. Función principal
- El ADN es el almacén permanente de la información genética. Contiene las instrucciones para construir y mantener un organismo.
- El ARN actúa como un intermediario funcional. Transcribe la información del ADN y la lleva a los ribosomas para que se traduzca en proteínas.
Existen varios tipos de ARN con funciones específicas, como el ARN mensajero (ARNm), ARN ribosómico (ARNr) y ARN de transferencia (ARNt).
En resumen, el ADN es como un archivo maestro que guarda la información genética de forma estable, mientras que el ARN es un mensajero activo que copia esa información y la utiliza para fabricar proteínas. Ambos son esenciales para la vida, pero cumplen roles diferentes dentro de la célula.
Aunque el ADN y el ARN comparten la función esencial de almacenar y transmitir información biológica, son moléculas diferentes tanto en estructura como en propósito, y cada una cumple un papel propio dentro del delicado engranaje de la vida. El ADN puede entenderse como el gran archivo maestro, la biblioteca completa del organismo, donde se conserva, de forma estable y protegida, la información que define a cada ser vivo. En cambio, el ARN actúa como un mensajero dinámico que extrae pequeñas partes de esa información y las lleva al lugar donde se necesitan para construir proteínas o regular procesos celulares. Ambas moléculas cooperan para que las instrucciones de la vida se mantengan intactas y puedan utilizarse en cada momento de manera precisa.
El ADN está formado por dos cadenas complementarias que se enrollan formando la icónica doble hélice. Esta estructura, sólida y estable, es ideal para guardar información durante largos periodos sin que se altere. Sus bases son cuatro: adenina, timina, citosina y guanina. El ARN, en cambio, suele presentarse como una sola cadena flexible y moldeable, lo que le permite adoptar múltiples formas según la función que deba desempeñar. Sus bases también son cuatro, pero incluye uracilo en lugar de timina. Este pequeño detalle químico —tan sencillo como cambiar una letra en el alfabeto— marca una diferencia funcional profunda que ayuda a la célula a distinguir qué molécula está leyendo y en qué contexto debe interpretarla.
Otra diferencia reside en el tipo de azúcar presente en su estructura: el ADN utiliza desoxirribosa, mientras que el ARN contiene ribosa. Este cambio, aunque parece menor, afecta a la estabilidad y al comportamiento químico de ambas moléculas. La desoxirribosa aporta mayor resistencia al ADN, preservando la información genética durante toda la vida del organismo. La ribosa, en cambio, hace que el ARN sea más reactivo y temporal, cualidad perfecta para cumplir funciones rápidas y específicas que no requieren permanencia.
El ARN no es un simple mensajero que lleva instrucciones del ADN a las fábricas celulares encargadas de construir proteínas. Existen diversos tipos de ARN, cada uno con un papel distinto: algunos leen los genes, otros ensamblan aminoácidos, otros regulan la expresión génica, y otros incluso silencian genes para evitar que se activen en momentos inadecuados. Esta diversidad convierte al ARN en una herramienta versátil, capaz de coordinar procesos complejos con una precisión asombrosa.
Comprender estas diferencias permite apreciar por qué la vida ha evolucionado con dos moléculas complementarias en lugar de una sola. El ADN garantiza la estabilidad y continuidad de la información a lo largo de las generaciones, actuando como una memoria duradera. El ARN, en cambio, aporta dinamismo, adaptabilidad y capacidad de respuesta inmediata. Juntos forman un sistema elegante en el que la información no solo se almacena, sino que también se interpreta, se transforma y se utiliza para sostener la existencia misma de los organismos. En esta interacción entre estabilidad y movimiento reside uno de los secretos más hermosos de la biología molecular: la vida sabe conservar, pero también sabe cambiar.
Representación tridimensional de una molécula de ARN, mostrando su estructura de cadena simple y la composición variada de sus nucleótidos. Imagen: generada con IA (OpenAI).

3.4 Organización del material genético (ADN, cromosomas, cromatina, histonas)
El ADN contiene la información genética necesaria para construir y mantener la vida. Pero esta molécula, aunque extremadamente larga, cabe dentro del diminuto núcleo de cada célula gracias a un sistema altamente organizado de empaquetamiento.
1. ADN y su longitud
El ADN de una sola célula humana, si se desenrollara por completo, mediría unos dos metros. Para que quepa dentro del núcleo —una estructura microscópica— debe estar compactado sin perder su capacidad de ser leído y utilizado.
2. Cromatina: la forma empaquetada del ADN
El ADN no está suelto, sino asociado a unas proteínas especiales llamadas histonas. Esta combinación forma la cromatina, que es la forma habitual en la que se encuentra el ADN dentro del núcleo.
Existen dos estados principales de cromatina:
Eucromatina: menos compactada y activa en la transcripción, es decir, aquí los genes pueden leerse con facilidad.
Heterocromatina: más compactada, con genes que suelen permanecer inactivos o silenciosos.
3. Histonas: las proteínas organizadoras
Las histonas actúan como pequeños “carretes” alrededor de los cuales se enrolla el ADN. Esta unión forma unidades llamadas nucleosomas, que se pueden imaginar como las cuentas de un collar.
Además de compactar el ADN, las histonas regulan su accesibilidad: dependiendo de cómo esté enrollado el ADN, ciertos genes pueden activarse o quedar bloqueados. Esta regulación es esencial para el funcionamiento celular.
4. Cromosomas: el máximo nivel de compactación
Cuando la célula va a dividirse, la cromatina se condensa aún más formando cromosomas, estructuras visibles al microscopio. Cada cromosoma contiene una única molécula de ADN fuertemente empaquetada.
En los seres humanos, cada célula posee 46 cromosomas (23 pares), donde se distribuyen todos los genes que determinan nuestras características biológicas.
En resumen
El ADN es la molécula que contiene la información genética.
Habitualmente se organiza como cromatina asociada a histonas.
Cuando la célula se divide, la cromatina se condensa en cromosomas.
Este sistema permite almacenar el ADN en el núcleo y regular qué genes se utilizan en cada momento.
Aunque el empaquetamiento pueda parecer un simple asunto de “orden”, en realidad es uno de los mecanismos más finos y sofisticados de toda la biología. Cada célula debe guardar una enciclopedia completa en un espacio microscópico sin que las páginas se mezclen, se rompan o se pierdan. Para lograrlo, la naturaleza ha desarrollado un sistema de organización extraordinario que recuerda a la perfección de una biblioteca bien catalogada.
El ADN, por sí solo, sería demasiado largo, demasiado frágil y demasiado caótico. Pero las histonas actúan como bibliotecarios moleculares que organizan cada fragmento, lo enrollan con precisión y lo colocan en su lugar adecuado. La cromatina no es un simple “rollo de ADN comprimido”, sino un tejido vivo que se abre y se cierra según las necesidades de la célula. Cuando un gen debe activarse, la estructura se relaja; cuando debe silenciarse, se compacta. Esta danza constante entre apertura y cierre convierte al empaquetamiento del ADN en un sistema regulador tan importante como los propios genes.
Comprender esta organización permite entender por qué dos células con el mismo ADN pueden comportarse de forma completamente distinta. El secreto no está en los genes que poseen, sino en cuáles tienen accesibles y cuáles permanecen guardados bajo llave. Así, la arquitectura del ADN es también una forma de control biológico, una manera de decidir qué parte del libro de la vida se lee en cada momento.
3.5 Genes estructurales y reguladores
No todos los genes cumplen el mismo papel dentro del ADN. Aunque todos contienen información genética, podemos distinguir dos grandes tipos según su función: genes estructurales y genes reguladores.
Para comprender la diferencia entre genes estructurales y reguladores, es útil imaginar una gran ciudad. Los genes estructurales serían los obreros, los arquitectos, los fontaneros, los agricultores: quienes producen los materiales y mantienen en funcionamiento cada parte del sistema. Cada uno tiene una tarea concreta y produce algo necesario, como una proteína para formar músculos, una enzima que facilita la digestión o una hormona que coordina el crecimiento.
Los genes reguladores, en cambio, serían los planificadores urbanos, los responsables de decidir qué edificio se construye, qué calles se abren y qué servicios deben activarse en cada barrio. No producen materiales, pero sin ellos reinaria el caos: habría proteínas fabricándose donde no hacen falta, tejidos formándose en lugares inadecuados y células actuando sin coordinación.
Gracias a los genes reguladores, una célula de la piel no fabrica neuronas y una célula del hígado no produce queratina. El cuerpo se organiza siguiendo un plan maestro que indica qué genes se activan y qué genes permanecen durmiendo. Este sistema hace posible que el embrión se desarrolle siguiendo un orden preciso, que cada órgano tenga una función específica y que el organismo pueda adaptarse a los cambios del entorno.
Los factores de transcripción —productos de muchos genes reguladores— son como llaves que abren y cierran interruptores. Sin ellos, la vida sería un desorden de instrucciones simultáneas sin sentido. La existencia de dos tipos de genes, unos que producen y otros que coordinan, convierte a la célula en un sistema equilibrado, eficiente y extraordinariamente preciso.
Genes estructurales
Son los genes que contienen la instrucción directa para fabricar una proteína específica. Estas proteínas pueden:
formar estructuras físicas (como queratina o colágeno),
actuar como enzimas que facilitan reacciones químicas,
funcionar como hormonas (como la insulina),
o ser receptores en la superficie de las células.
Por ejemplo, el gen que codifica la insulina es un gen estructural: lleva la receta exacta para producir esa proteína.
Genes reguladores
Los genes reguladores no codifican directamente proteínas funcionales, sino que controlan cuándo y cómo se activan otros genes, especialmente los estructurales. Actúan como interruptores, moduladores o directores de orquesta.
Gracias a ellos:
una misma célula puede activar diferentes genes según la etapa del desarrollo,
distintos tejidos pueden especializarse (una célula muscular y una neurona tienen el mismo ADN, pero expresan genes distintos),
el organismo puede responder a cambios del entorno.
Muchos genes reguladores producen factores de transcripción, proteínas que se unen al ADN y favorecen o impiden la expresión de ciertos genes.
En resumen
Los genes estructurales contienen instrucciones para fabricar proteínas funcionales.
Los genes reguladores controlan la activación o desactivación de esos genes estructurales y permiten que las células se comporten de manera coordinada y especializada.
Concepto visual de una mutación genética representada como un bloque alterado dentro de una secuencia de ADN. © Mohdizzuanbinroslan.

3.6 Mutaciones: tipos y consecuencias
El ADN es una molécula estable y cuidadosamente protegida por la célula, pero aun así pueden producirse cambios en su secuencia. Estos cambios reciben el nombre de mutaciones. Una mutación consiste en una alteración —grande o pequeña— en la información genética, y puede tener efectos muy distintos: desde no causar ninguna consecuencia hasta modificar una proteína y provocar una enfermedad.
Las mutaciones son cambios en la secuencia del ADN, pequeñas variaciones que alteran las “letras” con las que está escrito el código genético. Aunque la palabra pueda despertar inquietud, en realidad las mutaciones forman parte natural de la vida y han acompañado a los seres vivos desde sus orígenes. Son el motor último de la diversidad biológica y la materia prima sobre la que actúa la evolución. Sin mutaciones, todas las especies serían copias idénticas de sí mismas y la vida no habría podido adaptarse a los cambios del planeta.
Una mutación puede surgir de manera espontánea cuando la célula copia su ADN antes de dividirse, o puede ser provocada por agentes externos como la radiación, ciertos productos químicos o errores en los procesos celulares. En la mayoría de los casos, estos cambios son imperceptibles: no afectan al organismo o quedan corregidos por los sofisticados sistemas de reparación que poseen nuestras células. En otras ocasiones, una mutación puede alterar la función de un gen, modificar una proteína o cambiar la forma en que un conjunto de genes se activa o se silencia.
El efecto de una mutación depende siempre del lugar donde ocurre y de la función del gen afectado. Algunas mutaciones son beneficiosas y permiten que un organismo se adapte mejor a su entorno. Otras resultan neutras y no modifican en absoluto el funcionamiento celular. Y algunas, cuando dañan un proceso biológico importante, pueden tener efectos negativos y originar enfermedades genéticas o aumentar la predisposición a ciertos trastornos. Esta diversidad de impactos convierte a las mutaciones en un campo de estudio esencial tanto para la genética básica como para la medicina moderna.
En el ser humano, muchas mutaciones se heredan de padres a hijos, permaneciendo silenciosas durante generaciones hasta que se manifiestan bajo determinadas circunstancias. Otras aparecen por primera vez en un individuo concreto. Esta mezcla constante entre lo heredado y lo nuevo explica por qué cada persona es única y por qué incluso hermanos con un mismo origen genético pueden presentar rasgos diferentes.
Comprender las mutaciones significa comprender cómo se renueva la información genética y cómo se mantiene el equilibrio entre la estabilidad necesaria para conservar nuestra identidad biológica y la variación indispensable para que la vida siga evolucionando. Estudiarlas permite esclarecer el origen de muchas enfermedades, mejorar el diagnóstico temprano y desarrollar terapias que actúen directamente sobre el ADN o sus procesos asociados. Pero también nos recuerda que toda forma de vida es, en cierto modo, una historia escrita a base de cambios: una narración en la que cada mutación, por pequeña que sea, añade un matiz nuevo al gran relato de la biología.
Aunque solemos asociar “mutación” con algo negativo, muchas son neutrales y algunas incluso pueden resultar beneficiosas para la evolución de una especie. Lo importante es comprender qué tipos existen y cómo afectan al funcionamiento de los genes.
I. Mutaciones puntuales
Son cambios en una sola base del ADN. Pueden ser:
Sustituciones: una base se reemplaza por otra.
Inserciones: se añade una base nueva.
Deleciones: se pierde una base.
Cuando afectan a la secuencia de una proteína, pueden alterar su estructura y su función. Un ejemplo clásico es la anemia falciforme, provocada por una única sustitución en el gen de la hemoglobina.
II. Mutaciones génicas
Afectan a fragmentos más amplios de un gen completo. Pueden modificar la longitud o la estructura de la proteína resultante o impedir su fabricación.
III. Mutaciones cromosómicas
Se producen cuando cambia la forma o la organización de los cromosomas. Pueden incluir:
Duplicaciones
Inversiones
Translocaciones
Deleciones grandes
Estos cambios pueden alterar varios genes al mismo tiempo.
IV. Mutaciones numéricas
Afectan al número total de cromosomas. Se producen por errores en la meiosis y suelen tener consecuencias importantes. Ejemplos:
Trisomía 21 (síndrome de Down)
Trisomía 18
Monosomía X (síndrome de Turner)
Consecuencias de las mutaciones
Las mutaciones pueden clasificarse según su efecto:
Neutrales: no modifican la proteína o no afectan al organismo.
Perjudiciales: alteran la función de un gen y pueden causar enfermedad.
Beneficiosas: aportan una ventaja adaptativa y pueden fijarse evolutivamente.
El impacto depende del tipo de mutación, del gen afectado y del tejido en el que se produzca. Además, muchas mutaciones pueden ser reparadas por mecanismos celulares que vigilan la integridad del ADN. Estas reparaciones son fundamentales para mantener la estabilidad genética.
En conjunto, las mutaciones son variaciones en la secuencia del ADN que pueden tener efectos muy distintos. Constituyen tanto el origen de muchas enfermedades genéticas como la base de la diversidad biológica y la evolución.
Con esto concluye la exploración de la estructura y función del ADN y los genes. Desde su organización dentro del núcleo hasta las mutaciones que pueden alterar su mensaje, este bloque sienta las bases para comprender cómo la información genética se copia, se transmite y, en ocasiones, cambia. En el siguiente apartado abordaremos cómo se replica el ADN y cómo funciona el ciclo celular, elementos esenciales para la herencia y para el funcionamiento de todos los organismos.
Mutaciones y enfermedades genéticas: ejemplos clave
Las mutaciones no solo explican la diversidad biológica, sino que también pueden ser el origen de numerosas enfermedades. Algunas alteraciones en los genes cambian la estructura o la función de las proteínas, y ese cambio repercute directamente en el organismo. Entre las enfermedades más estudiadas se encuentran la fibrosis quística, la anemia falciforme, la hemofilia y ciertos cánceres hereditarios. Cada una de ellas muestra cómo una variación concreta en el ADN puede tener efectos profundos.
Fibrosis quística. Está causada por mutaciones en el gen CFTR, responsable de una proteína que regula el paso de sales y agua en las células epiteliales. La mutación más común provoca que la proteína no funcione correctamente. Como resultado, el moco de pulmones y otros órganos se vuelve más espeso, dificultando la respiración y la digestión. Es una enfermedad autosómica recesiva: para manifestarla se necesitan dos copias defectuosas del gen.
Anemia falciforme. Es un ejemplo clásico de cómo una única sustitución en una base puede modificar toda una proteína. En este caso, cambia la estructura de la hemoglobina y los glóbulos rojos adoptan forma de “hoz”, siendo más frágiles y menos eficientes. La mutación es recesiva, y las personas portadoras —con una sola copia alterada— no desarrollan la enfermedad, aunque sí muestran una curiosa ventaja evolutiva: tienen mayor resistencia a la malaria.
Hemofilia. La hemofilia A y B se deben a mutaciones en genes localizados en el cromosoma X que intervienen en la coagulación de la sangre. Esto explica por qué afecta sobre todo a los varones, mientras que las mujeres suelen ser portadoras sin síntomas. Cuando el factor de coagulación falla, incluso pequeñas lesiones pueden producir hemorragias graves o internas.
Cáncer hereditario. Aunque la mayoría de los cánceres no se heredan, existe un grupo provocado por mutaciones que se transmiten de padres a hijos. Son alteraciones en genes que normalmente frenan la división celular o reparan el ADN. Cuando estos genes fallan, las células acumulan errores con más facilidad. Entre los ejemplos más conocidos están los genes BRCA1 y BRCA2, relacionados con el cáncer de mama y ovario, y el gen APC, asociado al cáncer colorrectal hereditario.
En conjunto, estos casos muestran cómo una mutación, por pequeña que sea, puede afectar a procesos fundamentales del organismo y derivar en enfermedades de gran impacto.
Mecanismos de reparación del ADN
El ADN está sometido a agresiones constantes: radiación solar, sustancias químicas, errores en la replicación o simples reacciones internas del metabolismo pueden dañarlo. Si estos daños no se corrigen, pueden convertirse en mutaciones permanentes. Para evitarlo, las células disponen de sistemas de vigilancia y reparación que actúan de manera continua.
- Reparación por escisión de bases. Este mecanismo elimina bases dañadas o alteradas. Una enzima reconoce la base incorrecta, la corta y la reemplaza por la base correcta. Es un sistema muy preciso y fundamental para corregir daños leves y frecuentes.
- Reparación por escisión de nucleótidos. Cuando el daño afecta a varios nucleótidos —por ejemplo, después de la exposición a luz ultravioleta—, la célula retira un fragmento más grande de la hebra afectada y sintetiza uno nuevo tomando como modelo la hebra intacta. Si este sistema falla, pueden aparecer enfermedades raras como la xerodermia pigmentosa, caracterizada por una gran sensibilidad a la radiación solar.
- Reparación de errores de replicación (mismatch repair). Durante la duplicación del ADN pueden introducirse bases incorrectas. Este mecanismo identifica la hebra recién sintetizada, localiza el error y lo corrige antes de que se convierta en una mutación fija. Alteraciones en este sistema se han relacionado con algunos cánceres hereditarios de colon.
- Reparación de roturas de doble cadena. Cuando se rompen ambas hebras del ADN —una situación especialmente peligrosa— la célula puede optar por dos vías.
– La unión de extremos no homólogos vuelve a unir los fragmentos rotos de manera rápida pero imprecisa, lo que puede introducir pequeñas mutaciones.
– La recombinación homóloga utiliza una copia intacta del ADN como molde, logrando una reparación mucho más precisa. Esta vía es especialmente importante durante ciertas fases del ciclo celular, cuando existe una copia hermana del cromosoma.
Apoptosis. Si el daño es demasiado grande y no puede repararse, la célula activa un mecanismo de autodestrucción programada. De este modo evita que células potencialmente peligrosas sigan dividiéndose y acumulando errores. Es una defensa clave frente al desarrollo de tumores.
Gracias a todos estos mecanismos, el ADN mantiene su estabilidad a lo largo de la vida de un organismo. Sin ellos, las mutaciones se acumularían rápidamente y la vida no podría sostenerse de manera fiable.
Estructura biológica del ADN con concepto de mutación genética, representación 3D. Gráfico en movimiento. © Vinkfan.
La mutación genética es un cambio en la secuencia del ADN que altera, de manera pequeña o profunda, la información que usan las células para funcionar. Puede surgir cuando la doble hélice del ADN sufre una rotura, una modificación química o un error durante la copia del material genético. En condiciones normales, la célula dispone de sistemas muy eficientes para reparar estos daños y restaurar la estructura original, pero a veces la reparación no es exacta o el daño es demasiado severo, y entonces aparece una mutación establecida en el gen.
Los motivos por los que se produce una mutación pueden ser internos o externos. Entre los internos se encuentran los errores espontáneos que tienen lugar cuando la célula duplica su ADN; la maquinaria de replicación trabaja con enorme precisión, pero nunca con una perfección absoluta, y con el tiempo estos fallos puntuales se acumulan. También influyen procesos naturales como el envejecimiento, la oxidación celular o el desgaste bioquímico propio de la vida. Entre las causas externas destacan la radiación ultravioleta, los rayos X, ciertas sustancias químicas, algunos virus y los agentes que producen estrés oxidativo. Todos ellos pueden alterar la forma de las bases nitrogenadas, romper la cadena o introducir sustituciones que cambian el sentido de un gen.
Aunque las mutaciones forman parte inevitable de la biología, hay medidas que reducen su frecuencia. Mantener una vida con baja exposición a agentes mutágenos, evitar el tabaco y sustancias tóxicas, protegerse del sol de forma adecuada, reducir la exposición innecesaria a radiaciones, llevar una alimentación rica en antioxidantes y favorecer un estilo de vida que mantenga el equilibrio celular son formas de disminuir ese daño acumulativo. El organismo posee sistemas de reparación muy potentes, pero su eficacia depende también de la nutrición, del descanso, del estado general de salud y de la ausencia de agresiones repetidas.
En esencia, una mutación es la huella que queda cuando la célula no consigue restaurar por completo una lesión en el ADN. Puede ser inocua, útil o perjudicial, pero siempre representa un cambio en la información que nos define. Entender este proceso ayuda a valorar la importancia de proteger al organismo de los agentes que dañan el ADN y de mantener un entorno biológico favorable a la estabilidad genética.
3.7 Regulación de la expresión génica
Aunque todas las células del cuerpo contienen el mismo ADN, no todas funcionan igual. Una célula muscular no se comporta como una neurona, y una célula de la piel no actúa como una célula del hígado. Esta diversidad es posible gracias a un proceso fundamental: la regulación de la expresión génica.
La expresión génica consiste en “leer” un gen y fabricar su producto, normalmente una proteína. Pero esta lectura no ocurre de manera constante ni en todas las células por igual. El organismo controla cuidadosamente cuándo, dónde y en qué cantidad se activan los genes. De este control depende el desarrollo, la adaptación al entorno y el buen funcionamiento del organismo.
Aunque todas las células del cuerpo contienen el mismo ADN, no todas funcionan igual. Una célula muscular no se comporta como una neurona, y una célula de la piel no actúa como una célula del hígado. Esta diversidad es posible gracias a un proceso fundamental: la regulación de la expresión génica.
La expresión génica consiste en “leer” un gen y fabricar su producto, normalmente una proteína. Pero esta lectura no ocurre de manera constante ni en todas las células por igual. El organismo controla cuidadosamente cuándo, dónde y en qué cantidad se activan los genes. De este control depende el desarrollo, la adaptación al entorno y el buen funcionamiento del organismo.
Antes de que un gen pueda activarse o silenciarse, la célula debe gestionar una serie de niveles de organización internos que condicionan su disponibilidad. El ADN se encuentra empaquetado en una arquitectura compleja de cromatina, compuesta por proteínas llamadas histonas que enrollan y compactan la doble hélice. Esta estructura no es fija ni uniforme: puede abrirse, relajarse o comprimirse según las necesidades del momento. Cuando la cromatina está muy apretada, los genes quedan ocultos y son difíciles de leer; cuando se relaja, las enzimas encargadas de la transcripción pueden acceder a ellos con mayor facilidad. Así, incluso antes de entrar en el encendido o apagado de un gen, el primer paso consiste en decidir si la maquinaria celular puede siquiera acercarse a la secuencia que desea utilizar.
A este nivel estructural se suman señales químicas que actúan como marcas sobre el ADN o sobre las propias histonas. Estas modificaciones no cambian los genes en sí, pero influyen profundamente en su legibilidad. Un grupo metilo añadido en un punto concreto puede bloquear el acceso, mientras que una marca de acetilo puede favorecer la apertura de la cromatina. La célula dispone de un auténtico sistema de códigos que interpreta constantemente para determinar qué regiones deben permanecer activas y cuáles deben mantenerse inactivas. Este lenguaje químico constituye una capa adicional de regulación que convierte a la cromatina en un mapa dinámico, sensible a factores internos y externos.
Además de los mecanismos estructurales y químicos, la célula debe coordinar señales provenientes del entorno. Hormonas, nutrientes, estrés, temperatura o señales de otras células influyen en la decisión de activar o silenciar determinados genes. Esta capacidad de respuesta permite que un mismo genoma dé lugar a comportamientos completamente distintos según la función y las circunstancias de cada célula. La regulación de la expresión génica es, por tanto, una conversación continua entre la información heredada, la arquitectura molecular y las necesidades fisiológicas del organismo.
Solo cuando todos estos niveles de control se han integrado es posible hablar propiamente del encendido y apagado de los genes, un proceso finamente ajustado que sostiene la vida y garantiza que cada célula cumpla su papel.
I. Encendido y apagado de los genes
El encendido y apagado de los genes, también llamado regulación transcripcional, es uno de los procesos más finos y decisivos de la biología celular. Cada célula debe responder a su entorno interno y externo seleccionando qué genes utilizar y cuáles mantener silenciosos, como si manejara un panel con miles de interruptores que pueden activarse con distinta intensidad. Esta regulación no ocurre de manera aislada, sino como parte de una red compleja de señales que se interpretan en tiempo real. La célula nunca se limita a abrir o cerrar un gen de forma simple; ajusta gradualmente su actividad, la acelera, la reduce o la mantiene en un estado de reposo vigilante, preparado para activarse cuando sea necesario.
El primer paso en este proceso es la interacción entre el ADN y las proteínas reguladoras. Los genes contienen regiones específicas, llamadas promotores, que actúan como puntos de acceso. Sobre ellas se fijan proteínas conocidas como factores de transcripción, que funcionan como auténticos guardianes de entrada. Algunos de estos factores impulsan la lectura del gen, mientras que otros lo bloquean. Su presencia o ausencia, así como su combinación, determina si la maquinaria celular que copia el ADN en ARN puede ponerse en marcha. Este sistema permite que cada célula utilice solo una parte del inmenso repertorio genético que posee, adaptando su identidad y función.
A medida que la célula recibe señales, los factores de transcripción actúan como mensajeros que interpretan esas instrucciones. Un estímulo hormonal puede activar un gen que estaba inactivo, mientras que una señal de estrés puede silenciar temporalmente otro para conservar energía. Los promotores y los elementos reguladores que rodean a los genes funcionan como una superficie de aterrizaje para estas proteínas, que leen las condiciones y deciden la respuesta apropiada. Al hacerlo, permiten que el gen se exprese con mayor o menor intensidad, algo esencial para regular procesos tan variados como el crecimiento, la división celular o la respuesta inmunitaria.
Sin embargo, la regulación no se limita a la activación del promotor. En regiones más alejadas del gen existen secuencias denominadas potenciadores y silenciadores, capaces de modular a distancia la expresión génica. Estas secuencias actúan como amplificadores o frenos, aumentando o reduciendo la actividad de un gen según las necesidades del momento. La interacción entre potenciadores, silenciadores y promotores crea una especie de arquitectura tridimensional en la que el ADN se pliega para acercar físicamente zonas distantes. Este plegamiento permite que la célula realice ajustes finísimos sin necesidad de alterar la secuencia genética, solo reorganizando su estructura.
Una vez que el gen está encendido, la célula también controla cuánto tiempo permanecerá activo. La transcripción puede detenerse de forma rápida si la situación lo exige, permitiendo respuestas inmediatas a cambios del entorno. Algunos genes se activan solo durante unos segundos, mientras que otros pueden mantenerse activos durante horas o días. Esta flexibilidad garantiza que la actividad celular sea precisa y que no se produzcan excesos que comprometan su equilibrio.
El apagado de los genes es tan importante como su encendido. No consiste simplemente en cerrar un interruptor, sino en redistribuir las marcas químicas, retirar factores de transcripción, compactar la cromatina o introducir modificaciones epigenéticas que impidan la reactivación indeseada. En muchas ocasiones, este apagado es esencial para mantener la identidad celular; una célula de la piel debe silenciar para siempre los genes que permiten la función neuronal, mientras que una célula muscular no debe activar genes propios de los linfocitos. La persistencia del silencio es parte de la estabilidad de los tejidos y una garantía de que cada célula cumple su papel de forma coherente.
Este sistema, aparentemente sencillo, es en realidad un entramado de interacciones modulado por la genética, la epigenética y el ambiente. De él depende que el organismo crezca de manera ordenada, que responda a los cambios, que repare sus tejidos y que mantenga en equilibrio todas las funciones vitales. El encendido y apagado de los genes es, en última instancia, la coreografía silenciosa que da forma a la vida y sostiene su diversidad.
Los genes pueden estar:
Activos (expresados): la célula produce la proteína correspondiente.
Inactivos (silenciados): la célula no lee ese gen en ese momento.
El estado de activación varía según el tipo de célula, su etapa de desarrollo o las señales externas que recibe (hormonas, nutrientes, temperatura, estrés, etc.).
II. Mecanismos de regulación
La regulación de los genes no depende de un único mecanismo, sino de una constelación de procesos que se superponen, se corrigen mutuamente y trabajan en distintos niveles de la estructura celular. Tras comprender la idea general del encendido y apagado de los genes, resulta imprescindible adentrarse en los mecanismos concretos que hacen posible este control tan fino y específico. La célula opera como un sistema profundamente organizado, en el que cada capa aporta una forma distinta de ajustar la actividad genética. Desde la arquitectura interna del ADN hasta la estabilidad del ARN, cada etapa del flujo de información genética puede ser modulada para adaptarse a las necesidades del organismo.
Estos mecanismos no actúan de manera aislada. Al contrario, forman una red donde los cambios estructurales en la cromatina, las marcas epigenéticas, la acción de los factores de transcripción, la edición del ARN y la regulación de las proteínas interactúan entre sí, generando respuestas completísimas y matizadas. La célula puede decidir si un gen será accesible, si se transcribirá con más o menos intensidad, si su ARN será procesado o degradado, o si la proteína resultante será activada o desactivada. Todo ello crea un sistema de regulación que no solo determina la función de cada célula, sino que le permite adaptarse en segundos a señales externas, mantener su identidad durante años o modificar su comportamiento cuando las circunstancias lo exigen.
Comprender estos mecanismos es comprender la lógica de la vida: cómo un embrión pasa de una única célula a un organismo completo, cómo un tejido se repara tras una lesión, cómo una célula inmunitaria responde a una infección o cómo un organismo entero se adapta a cambios en el entorno. Cada uno de estos procesos se sostiene en la capacidad de regular la expresión génica con precisión. A partir de aquí, el estudio de los mecanismos de regulación nos abre las puertas a una serie de niveles de control que revelan la extraordinaria sofisticación del funcionamiento celular y nos permiten apreciar, con mayor claridad, el dinamismo que hace posible la existencia misma.
La célula utiliza distintos niveles de control:
a) Regulación en la cromatina. El ADN puede estar más o menos compacto.
Eucromatina (abierta): los genes se pueden leer.
Heterocromatina (compacta): los genes quedan inaccesibles.
Las modificaciones químicas de las histonas o del propio ADN influyen en esta accesibilidad.
b) Regulación durante la transcripción. Es el nivel más importante. Los factores de transcripción —proteínas reguladoras— se unen al ADN y actúan como interruptores que activan o bloquean a los genes.
c) Regulación después de la transcripción. Incluso después de crear el ARN mensajero, la célula puede modificarlo, acortarlo o destruirlo antes de que llegue a los ribosomas. Esto ajusta la cantidad final de proteína producida.
d) Regulación de las proteínas ya formadas. Algunas proteínas necesitan ser activadas, modificadas o incluso degradadas para cumplir correctamente su función.
III. ¿Por qué es necesaria esta regulación?
La regulación de la expresión génica no es un lujo ni un adorno de la biología, sino una condición imprescindible para que la vida pueda existir tal como la conocemos. Un organismo sería inviable si todos sus genes estuvieran activos al mismo tiempo, sin orden ni jerarquía, del mismo modo que una ciudad colapsaría si todas sus máquinas, luces y sistemas funcionaran simultáneamente sin ningún tipo de control. La célula necesita seleccionar qué información utilizar en cada momento, cuál debe permanecer en reposo y qué instrucciones deben reactivarse cuando cambian las condiciones del entorno. Esta selección constante garantiza que cada tejido cumpla su función, que cada célula mantenga su identidad y que el organismo pueda adaptarse de manera eficiente a las necesidades internas y a los estímulos externos.
La regulación también es necesaria porque la cantidad de información genética supera con creces lo que una célula puede manejar a la vez. El genoma contiene miles de genes, pero cada tipo celular solo utiliza una fracción concreta de ellos. Si una neurona expresara los genes propios de una célula hepática, o si una célula inmunitaria activara instrucciones que pertenecen al músculo esquelético, el organismo perdería la coherencia estructural que sostiene su funcionamiento. La regulación génica actúa como un filtro que orienta esa diversidad, asignando a cada célula un repertorio funcional que define quién es y qué debe hacer.
Además, la regulación es la base del desarrollo embrionario y del mantenimiento del organismo a lo largo de su vida. A medida que un embrión se divide, las células van adquiriendo identidades distintas porque activan combinaciones de genes distintas. Este proceso de diferenciación, extremadamente preciso, solo es posible gracias a la capacidad de encender y silenciar genes con un orden casi coreográfico. En la vida adulta, la regulación permite que los tejidos se reparen, que las respuestas inmunitarias se activen en el momento oportuno y que los ritmos internos se ajusten a las demandas energéticas. Sin este control, la vida sería caótica, inestable e incapaz de adaptarse al cambio.
La regulación génica también protege al organismo frente a amenazas internas. Las mutaciones, los errores de replicación o las alteraciones estructurales de la cromatina pueden desajustar la actividad de los genes. Si la célula no dispusiera de mecanismos para frenar o compensar estas desviaciones, los desequilibrios se acumularían y darían lugar a un mal funcionamiento generalizado, como ocurre en ciertos trastornos genéticos o en el cáncer. La regulación actúa como un sistema de vigilancia que detecta y corrige los excesos, restableciendo el equilibrio y evitando la activación de programas celulares inadecuados.
En última instancia, la regulación de los genes es necesaria porque la vida es un proceso dinámico. No basta con heredar un conjunto de instrucciones: es preciso interpretarlas, ajustarlas, combinarlas y adaptarlas a cada circunstancia. Esta regulación convierte la información genética en acción biológica; transforma una secuencia estática de ADN en un organismo capaz de sentir, responder, crecer y permanecer. Es en esta capacidad de regular la actividad de los genes donde la vida encuentra su flexibilidad, su orden interno y su extraordinaria diversidad.
La regulación de la expresión génica permite:
La diferenciación celular (que cada célula adopte un tipo y función).
El desarrollo embrionario, donde miles de genes se activan en el momento preciso.
La respuesta al entorno, como producir enzimas digestivas tras comer o activar defensas ante una infección.
El ahorro energético, ya que fabricar proteínas cuesta recursos y no sería viable expresarlo todo a la vez.
En resumen
Todas las células comparten el mismo ADN, pero no los mismos genes activos.
La expresión génica determina qué hace cada célula.
La regulación se ejerce a varios niveles: desde la estructura de la cromatina hasta la producción y activación de proteínas.
Gracias a este control, el organismo puede crecer, adaptarse y funcionar con precisión.
Modelo 3D de una doble hélice de ADN sobre fondo azul, utilizado para ilustrar el proceso de replicación genética. Imagen: © mahirkart (Envato Elements).

4. Replicación del ADN y ciclo celular
4.1 Proceso de replicación del ADN
Antes de que una célula pueda dividirse, debe hacer una copia completa de su ADN. A este proceso se le llama replicación, y es fundamental para asegurar que cada célula hija reciba la misma información genética.
La replicación del ADN es uno de los procesos más asombrosos y precisos que ocurren en la célula. Cada vez que una célula se divide, debe transmitir a sus descendientes una copia completa y fiel de su material genético. Esta tarea, que puede parecer sencilla desde fuera, exige una coordinación exquisita entre numerosas proteínas y una organización temporal perfectamente regulada. La molécula de ADN, con miles de millones de bases ordenadas en una secuencia exacta, debe deshacerse parcialmente, exponerse, copiarse y volver a ensamblarse sin perder su integridad. A pesar de su enorme complejidad, este mecanismo se lleva a cabo con una fidelidad extraordinaria, capaz de reproducir casi a la perfección la información que define a cada organismo.
La replicación comienza con la apertura controlada de la doble hélice. El ADN, normalmente estable y compacto, debe relajarse mediante el trabajo de enzimas especializadas que separan las dos cadenas complementarias y crean una especie de “ventana” de trabajo. Una vez abiertas, cada una de las hebras sirve como molde para construir una nueva cadena complementaria. La célula utiliza nucleótidos libres presentes en el núcleo y los incorpora siguiendo las reglas de complementariedad que rigen el código genético, garantizando que la nueva copia conserve la misma información que la original. Este proceso se desarrolla en múltiples puntos del ADN al mismo tiempo, lo que permite acelerar la duplicación de un genoma tan extenso.
La maquinaria de replicación funciona con una precisión casi absoluta, pero también con una inteligencia notable. Las enzimas implicadas no solo añaden nucleótidos, sino que verifican cada paso, corrigen errores y vigilan la continuidad de la cadena. La replicación tampoco es un acto aislado: se integra en un ciclo celular regulado, en el que la célula evalúa si su entorno es adecuado, si el ADN está intacto y si dispone de energía suficiente para emprender la duplicación. Solo cuando estas condiciones se cumplen, la replicación avanza, asegurando que el proceso se mantenga en equilibrio y que no se generen copias defectuosas que pongan en riesgo a la célula.
Entender cómo se replica el ADN es comprender el fundamento mismo de la continuidad biológica. Gracias a este mecanismo, la vida se transmite de una célula a otra, de un tejido a otro y de una generación a la siguiente. La replicación no es solo una copia mecánica, sino la perpetuación del orden molecular que sostiene al organismo, su desarrollo y su capacidad de adaptación. Es un proceso silencioso pero decisivo, una de las grandes obras maestras de la biología, y la base sobre la cual se apoyan la herencia, la mutación y la evolución.
Aunque tiene miles de pasos moleculares, el proceso puede entenderse de forma clara en tres etapas principales.
I. Inicio: apertura de la doble hélice
La replicación comienza en puntos específicos del ADN llamados orígenes de replicación. Una enzima llamada helicasa abre la doble hélice separando las dos hebras, como si deslizara una cremallera.
Esto crea una “burbuja de replicación” con dos horquillas donde el ADN se copiará.
II. Síntesis de nuevas hebras
Una vez separadas las hebras originales, otras enzimas entran en acción:
Primasa: coloca pequeños fragmentos de ARN para iniciar la copia.
ADN polimerasa: añade nucleótidos uno a uno, formando una hebra nueva complementaria a la original.
La replicación ocurre en ambas direcciones:
Hebra líder: se copia de forma continua.
Hebra retardada: se copia en fragmentos llamados fragmentos de Okazaki, que luego se unen.
III. Finalización y corrección
Cuando la ADN polimerasa termina de copiar, intervienen otras enzimas:
Exonucleasas: eliminan los fragmentos de ARN iniciales.
Ligasa: une los fragmentos y cierra la molécula.
Sistemas de corrección: revisan el ADN recién copiado para corregir errores.
Gracias a estos mecanismos, la replicación es extraordinariamente precisa, con una tasa de error final extremadamente baja.
En resumen
La replicación del ADN:
abre la doble hélice,
copia cada una de sus hebras,
repara errores,
y asegura que las células hijas tengan la misma información genética.
Con esto está perfectamente preparado el punto 4.1.
4.2 Ciclo celular: fases y regulación (Interfase, Mitosis y Meiosis)
El ciclo celular es el conjunto de etapas por las que pasa una célula desde que se forma hasta que se divide en dos células hijas. Es un proceso ordenado, cuidadosamente regulado y esencial para el crecimiento, la reparación de tejidos y la reproducción.
El ciclo celular es el proceso fundamental mediante el cual una célula crece, se prepara para dividirse y finalmente da origen a nuevas células. Es, en cierto modo, el latido interno de la vida microscópica: un ritmo ordenado y repetitivo que sostiene el desarrollo, la renovación de los tejidos y la continuidad de todas las especies. Desde las primeras etapas del embrión hasta la cicatrización de una herida o el reemplazo diario de millones de células gastadas, cada momento de nuestra existencia depende de este ciclo perfectamente orquestado.
A pesar de su aparente sencillez —una célula que se divide en dos—, el ciclo celular es extraordinariamente complejo y está regulado con una precisión casi absoluta. La célula no avanza a ciegas; evalúa continuamente si su ADN está íntegro, si dispone de suficiente energía y si las condiciones del entorno le permiten continuar. Esta vigilancia interna evita errores, previene mutaciones peligrosas y asegura que cada división se realice de forma correcta y segura.
El ciclo se divide en dos grandes etapas. La primera es la interfase, el largo periodo en el que la célula crece, se nutre, copia su ADN y se prepara para dividirse. Aunque desde fuera parezca un estado de reposo, en realidad es una etapa de enorme actividad y organización molecular. La segunda gran etapa es la división propiamente dicha, que puede seguir dos caminos distintos según el objetivo biológico: la mitosis, responsable de generar células idénticas para el crecimiento y mantenimiento del cuerpo, y la meiosis, un proceso especial que produce células reproductoras con la mitad de la información genética, permitiendo la formación de nuevos individuos.
Comprender el ciclo celular no solo es esencial para entender cómo crecen los organismos, sino también para comprender qué ocurre cuando este proceso se descontrola, como sucede en el cáncer o en ciertas enfermedades degenerativas. El equilibrio entre avance y detención, entre crecimiento y reparación, entre multiplicación y especialización, sostiene el delicado orden de la vida. Por eso, estudiar el ciclo celular es adentrarse en uno de los pilares más asombrosos de la biología: la capacidad de la vida para renovarse continuamente sin perder su identidad.
Aunque cada tipo de célula tiene ritmos distintos, todas siguen un mismo esquema general dividido en dos grandes momentos:
Interfase: la célula crece, se prepara y duplica su ADN.
División: la célula reparte su material genético y se divide (Mitosis o Meiosis).
I. Interfase: la gran preparación
La interfase ocupa más del 90 % del tiempo del ciclo celular. No es un periodo “de descanso”, sino una etapa intensa de trabajo interior.
Se divide en tres fases:
– G1 (Gap 1): crecimiento inicial
La célula aumenta de tamaño, fabrica proteínas y orgánulos, y realiza sus funciones normales.
Aquí decide si continúa el ciclo o si entra en reposo (fase G0).
– S (Síntesis): duplicación del ADN
Cada molécula de ADN se copia, produciendo cromosomas duplicados con dos cromátidas hermanas. Este paso es crucial para que cada célula hija reciba la misma información genética.
– G2 (Gap 2): verificación y ajustes finales
La célula revisa, repara posibles errores y produce los componentes necesarios para la división.
La interfase puede considerarse el corazón secreto del ciclo celular, un periodo en el que ocurre una actividad frenética, silenciosa y perfectamente coordinada. Mientras desde fuera la célula parece tranquila, en su interior se lleva a cabo una de las tareas más delicadas de la vida: asegurar que está preparada para dividirse sin poner en riesgo su integridad. En esta fase, la célula evalúa su entorno, revisa su maquinaria interna y toma decisiones cruciales para su futuro. Nada se deja al azar.
Durante la fase G1, la célula vive una etapa de expansión y evaluación. Crece, acumula energía, renueva sus estructuras internas y continúa desempeñando sus funciones específicas dentro del tejido al que pertenece. Es también el momento en que la célula mide si tiene recursos suficientes para dividirse. Si el entorno no es adecuado o la célula no necesita multiplicarse, puede entrar en un estado especial de reposo, la fase G0, donde permanece activa pero sin avanzar en el ciclo. Muchas células altamente especializadas, como las neuronas, pasan toda su vida en G0.
La fase S representa el momento más delicado de la interfase: la duplicación del ADN. La célula debe copiar sus dos metros de información genética letra por letra, sin errores, en un proceso de precisión extraordinaria. Para lograrlo, despliega una serie de enzimas que abren la doble hélice, leen cada hebra y construyen una nueva complementaria. Es un acto de ingeniería molecular tan complejo que la célula lo supervisa constantemente para evitar mutaciones que puedan comprometer su funcionamiento o el de sus futuras descendientes.
Durante la fase G2, la célula revisa meticulosamente el trabajo realizado. Si encuentra errores en el ADN recién duplicado, activa mecanismos de reparación que actúan como una brigada de mantenimiento. Al mismo tiempo, empieza a fabricar proteínas y estructuras que necesitará durante la división celular, como los microtúbulos que formarán el huso mitótico. Es un periodo final de verificación, ajuste y preparación en el que la célula se asegura de que todo esté listo para el paso decisivo: dividirse en dos células hijas funcionales e idénticas.
En conjunto, la interfase es mucho más que un puente entre dos divisiones: es la etapa que garantiza la continuidad de la vida celular, la fidelidad del material genético y el equilibrio del organismo. Es el momento donde se conjugan crecimiento, vigilancia, reparación, copia y preparación, demostrando que la vida, incluso a escala microscópica, se sostiene sobre un orden profundamente cuidado.
II. Mitosis: división para crecer y reparar
La mitosis ocurre en células somáticas (no reproductivas) y produce dos células hijas genéticamente idénticas.
La mitosis ocurre en células somáticas, es decir, en todas aquellas que no participan en la reproducción. Su función consiste en generar dos células hijas genéticamente idénticas, con la misma información hereditaria que la célula original. A través de este proceso, el organismo crece, reemplaza células dañadas y mantiene en equilibrio los tejidos que se renuevan constantemente, como la piel, la sangre o el revestimiento del intestino. En esencia, la mitosis es la responsable de que nuestro cuerpo pueda mantenerse en funcionamiento a lo largo de los años sin perder su identidad biológica.
A primera vista, la mitosis puede parecer simplemente una célula que se divide en dos, pero en realidad es un proceso extraordinariamente preciso que requiere una coordinación perfecta entre el ADN, el citoesqueleto y numerosas proteínas reguladoras. La célula debe asegurarse de que su material genético, recién duplicado durante la interfase, se distribuya de forma equitativa. Un error en este reparto podría traducirse en células con información incompleta o incorrecta, algo que comprometería su función y, en casos graves, podría dar lugar a enfermedades como el cáncer. Por eso, antes de iniciar esta fase, la célula activa mecanismos de control que confirman que el ADN está íntegro y que todos los componentes necesarios están listos para la división.
Durante la mitosis, el interior de la célula se transforma por completo. Los cromosomas, que habían permanecido relajados y extendidos durante la interfase, se compactan hasta volverse visibles al microscopio, como si el libro del ADN cerrara sus páginas para facilitar su transporte. El citoesqueleto, una red interna de fibras, reorganiza su arquitectura para formar el huso mitótico, una estructura que actuará como guía para mover los cromosomas y distribuirlos de forma simétrica. Poco a poco, el ADN se alinea, se separa y se reparte con una precisión que recuerda al trabajo de un relojero molecular.
La mitosis no solo permite el crecimiento del organismo durante la infancia y la adolescencia, sino que también mantiene la vida diaria. Cada cicatrización, cada renovación de células de la piel, cada reemplazo de glóbulos rojos o cada reparación interna tras un daño se debe a este proceso que opera sin descanso. Sin mitosis, los seres multicelulares no podrían existir tal como los conocemos: nos desgastaríamos sin regenerarnos y nuestro cuerpo se descompondría en pocas semanas.
En conjunto, la mitosis es un ejemplo perfecto de cómo la vida conjuga orden, equilibrio y continuidad. Gracias a ella, el organismo puede conservar su estructura, renovar sus tejidos y preservar su identidad genética a lo largo del tiempo. Es un acto de equilibrio cuidadosamente coreografiado, en el que cada célula reproduce fielmente la información que ha recibido para entregarla a la siguiente generación celular.
La mitosis es un proceso tan preciso que se divide en varias fases sucesivas. En cada una de ellas, la célula realiza movimientos cuidadosamente coreografiados para garantizar que su material genético se reparta de forma perfecta entre las dos células hijas. Aunque en apariencia sea un proceso continuo, al observarla de cerca se aprecia una secuencia de etapas tan elegantes como imprescindibles.
La primera fase es la profase, el inicio visible de la división. Durante este periodo, la cromatina que normalmente se encuentra extendida dentro del núcleo comienza a compactarse y se transforma en cromosomas claramente definidos. Cada cromosoma consiste en dos copias idénticas del ADN, llamadas cromátidas hermanas, unidas por una región central denominada centrómero. Al mismo tiempo, la envoltura nuclear empieza a desintegrarse, permitiendo que los cromosomas queden libres en el interior de la célula. A medida que esto ocurre, el citoesqueleto empieza a reorganizarse para formar el huso mitótico, una estructura de fibras que guiará el movimiento de los cromosomas con una precisión casi milimétrica.
La siguiente fase es la metafase, uno de los momentos más característicos de la mitosis. Todos los cromosomas se alinean exactamente en el centro de la célula, formando una especie de línea ecuatorial. Esta alineación no es casual: garantiza que cada cromátida tenga su propia fibra del huso conectada y que ambas puedan ser separadas con equilibrio. Es un instante de máxima tensión celular, como si la célula tomara aire antes del movimiento crucial que viene a continuación.
En la anafase, la célula ejecuta el paso decisivo. Las cromátidas hermanas, que hasta ahora permanecían unidas, se separan bruscamente y comienzan a desplazarse hacia polos opuestos de la célula, cada una guiada por su fibra del huso mitótico. Este momento asegura que cada célula hija reciba una copia completa del material genético. La velocidad y precisión con la que se mueven los cromosomas son sorprendentes, resultado de millones de años de evolución afinando este mecanismo esencial para la vida.
A continuación llega la telofase, fase en la que la célula empieza a restablecer el orden interno. Los cromosomas, ya situados en cada polo, comienzan a descompactarse y vuelven a su forma más relajada de cromatina, permitiendo que la lectura del ADN se reanude. Al mismo tiempo, se reconstruyen dos nuevas envolturas nucleares, una alrededor de cada grupo de cromosomas. Es el acto simbólico de crear los núcleos de las futuras células hijas.
Finalmente tiene lugar la citocinesis, el paso físico que separa la célula madre en dos células independientes. El citoplasma se divide, la membrana celular se estrangula en el centro y, poco después, aparecen dos células nuevas, cada una con su propio núcleo y su propio conjunto de orgánulos. Estas células hijas son genéticamente idénticas entre sí y a la célula original, listas para continuar su función o iniciar un nuevo ciclo celular.
En conjunto, estas fases muestran que la mitosis no es solo un acto de división, sino un ejemplo de orden, equilibrio y continuidad. La célula no improvisa; cada movimiento está milimetrado para garantizar la fidelidad genética y la supervivencia del organismo. Es una danza silenciosa y perfecta que sostiene el crecimiento, la reparación y la vida misma.
Consta de cuatro fases principales:
a) Profase
Los cromosomas se condensan (aparecen más compactos).
El núcleo comienza a desorganizarse.
Se forma el huso mitótico.
b) Metafase
Los cromosomas se alinean en el centro de la célula, formando la “placa metafásica”.
c) Anafase
Las cromátidas hermanas se separan y viajan hacia los polos opuestos.
d) Telofase
Se forman dos nuevos núcleos.
Los cromosomas se descondensan.
A esto le sigue la citocinesis, que divide el citoplasma en dos células completamente separadas. Resultado: dos células hijas idénticas, esenciales para el crecimiento y la reparación de tejidos.
Vista microscópica de la mitosis celular. Por ManuMata
III. Meiosis: división para crear gametos
La meiosis es un tipo especial de división celular que ocurre en órganos reproductores y produce gametos (óvulos y espermatozoides). Su característica clave es que reduce el número de cromosomas a la mitad, permitiendo que, al unirse en la fecundación, la especie conserve su número cromosómico.
A diferencia de la mitosis, la meiosis incluye dos divisiones consecutivas:
a) Meiosis I: división reduccional
Los cromosomas homólogos (uno del padre y otro de la madre) se emparejan.
Se produce el entrecruzamiento, intercambio de fragmentos que aumenta la variabilidad genética.
Se separan los homólogos → cada célula recibe la mitad de cromosomas.
b) Meiosis II: similar a una mitosis
Las cromátidas hermanas se separan.
Se forman en total cuatro células hijas, cada una con la mitad de los cromosomas y genéticamente únicas.
4. Regulación del ciclo celular
El ciclo celular cuenta con un sofisticado sistema de control formado por:
✔ Puntos de control (checkpoints)
Supervisan el proceso en momentos clave:
G1: ¿la célula está lista para replicar su ADN?
G2: ¿se duplicó el ADN sin errores?
M: ¿están los cromosomas correctamente alineados?
✔ Proteínas reguladoras (CDK y ciclinas)
Actúan como interruptores que activan o frenan fases del ciclo.
✔ Reparación del ADN
Si se detectan errores, la célula los repara antes de continuar. Cuando los daños son irreparables, puede entrar en apoptosis (muerte celular programada) para evitar problemas.
Ilustración de un científico analizando una molécula de ADN. © JumpStd.

4.3 Diferencias entre mitosis y meiosis en la herencia genética
La mitosis y la meiosis son dos tipos de división celular fundamentales en los organismos multicelulares. Aunque ambos procesos parten de una célula que contiene una dotación completa de ADN, sus funciones y resultados son muy distintos, especialmente en lo que respecta a la herencia genética.
La mitosis y la meiosis son dos tipos de división celular fundamentales en los organismos multicelulares. Aunque ambos procesos parten de una célula que contiene una dotación completa de ADN, sus funciones y resultados son muy distintos, especialmente en lo que respecta a la herencia genética. Mientras que la mitosis garantiza la continuidad, la reparación y el crecimiento del organismo produciendo células idénticas, la meiosis introduce variación y prepara el camino para la reproducción sexual al generar células con la mitad del material genético.
Comprender sus diferencias es esencial para entender no solo cómo se mantienen nuestros tejidos, sino también cómo se transmiten los rasgos de una generación a la siguiente y por qué cada individuo es único. La mitosis actúa como un mecanismo de conservación: asegura que una célula pueda dar lugar a dos copias fieles de sí misma, manteniendo intacto el ADN original y sosteniendo la estabilidad biológica de los organismos. La meiosis, en cambio, actúa como un mecanismo de diversidad: reorganiza y redistribuye el material hereditario para que cada gameto contenga una combinación única de genes. De esta manera, la reproducción sexual se convierte en una fuente constante de variación genética, indispensable para la evolución de las especies.
Las diferencias entre ambos procesos no solo se observan en su resultado final, sino también en su propósito, su mecánica y su impacto en la herencia. La mitosis produce células somáticas destinadas al crecimiento y mantenimiento del cuerpo, mientras que la meiosis produce células reproductoras que, al unirse en la fecundación, restaurarán la dotación completa de cromosomas en el nuevo organismo.
Estudiar ambas divisiones lado a lado permite comprender el delicado equilibrio entre estabilidad y cambio que sustenta la vida. Sin mitosis, un organismo no podría desarrollarse ni repararse; sin meiosis, no existirían la diversidad genética ni la capacidad de adaptación frente a un entorno en constante transformación. Juntas, estas dos formas de división celular explican tanto la continuidad de la identidad biológica como la variación que caracteriza a todos los seres vivos.
La mitosis: copia exacta para crecer y reparar
La mitosis ocurre en las células del cuerpo que no están involucradas en la reproducción (es decir, las células somáticas). Su función principal es generar células nuevas para el crecimiento del organismo, la renovación de tejidos o la cicatrización. En este proceso, una célula madre se divide en dos células hijas genéticamente idénticas a ella y entre sí.
Cada una de las células resultantes recibe el mismo número de cromosomas que la célula original. En los seres humanos, esto significa que si la célula madre tiene 46 cromosomas, cada célula hija también tendrá 46. No hay variación genética en este tipo de división: es una copia exacta.
La meiosis: diversidad para la reproducción
La meiosis, en cambio, es un proceso exclusivo de las células sexuales (óvulos y espermatozoides). Su función es reducir a la mitad el número de cromosomas, de modo que al unirse el óvulo y el espermatozoide durante la fecundación, el nuevo ser tenga el número correcto de cromosomas.
A diferencia de la mitosis, la meiosis implica dos divisiones celulares consecutivas y da lugar a cuatro células hijas, no dos. Cada una de estas células tiene solo la mitad del número de cromosomas de la célula original. En humanos, esto significa que tendrán 23 cromosomas en lugar de 46.
Además, durante la meiosis se produce una mezcla de material genético entre los cromosomas de origen materno y paterno. Este fenómeno, conocido como recombinación o entrecruzamiento, es el responsable de que cada célula sexual sea única, lo que explica por qué cada persona es genéticamente diferente, incluso entre hermanos.
Resumen de las diferencias
En resumen, la mitosis es un proceso de copia exacta que mantiene constante el número de cromosomas y no genera variabilidad genética. Es clave para el mantenimiento y crecimiento del cuerpo.
La meiosis, en cambio, reduce el número de cromosomas a la mitad y genera diversidad genética, algo esencial para la reproducción sexual y la evolución de las especies.
Análisis antropológico de un cráneo antiguo: el estudio del ADN y los restos óseos permite reconstruir la diversidad y la historia evolutiva de las especies humanas del pasado. © Yulikov.

La evolución humana es una historia tejida a partir de innumerables generaciones que transmitieron, una y otra vez, fragmentos de información genética capaces de sostener la vida en entornos cambiantes. Cada especie homínida que existió antes de nosotros —desde los australopitecos hasta los neandertales y los denisovanos— transportó en su ADN la huella de miles de adaptaciones acumuladas, algunas de las cuales perduran hoy en nuestra propia biología. El estudio de los cráneos, huesos y restos arqueológicos revela no solo cómo eran nuestros antepasados, sino también cómo esos rasgos se transmitieron, cambiaron o desaparecieron según las exigencias del medio.
La herencia genética desempeñó un papel central en esta trayectoria evolutiva. A lo largo de millones de años, pequeñas modificaciones en el ADN —mutaciones, combinaciones nuevas generadas por la reproducción sexual y variaciones acumuladas en las poblaciones— fueron moldeando características físicas como la forma del cráneo, la estructura de las mandíbulas, la capacidad craneal o la robustez de los huesos. Estos rasgos no surgieron al azar: cada uno respondía, en mayor o menor medida, a presiones ambientales concretas, como la necesidad de caminar erguidos, digerir nuevos alimentos, fabricar herramientas o sobrevivir a climas extremos.
La diversidad entre las distintas especies de homínidos fue el resultado de esa interacción constante entre genética y entorno. Los neandertales desarrollaron cuerpos fuertes y craneometría adaptada al frío glacial; los denisovanos aportaron variantes genéticas que hoy permiten a los pueblos tibetanos tolerar la altitud; los primeros Homo sapiens, más gráciles y flexibles, aprovecharon cambios conductuales y cognitivos para expandirse por el planeta. En cada caso, la herencia genética actuó como el hilo conductor que permitió la transmisión y preservación de los rasgos más útiles para cada especie.
Hoy, gracias al análisis del ADN antiguo extraído de restos óseos como el de la imagen, podemos reconstruir árboles evolutivos antes impensables. La genética moderna nos muestra que la evolución humana no fue un camino lineal, sino una red compleja de encuentros, extinciones y mezclas entre especies que compartieron territorios y, en algunos casos, descendencia. Esta interacción dejó marcas profundas en nuestro genoma actual, pruebas silenciosas de un pasado en el que la diversidad homínida era mucho mayor que la que vemos hoy.
Comprender esta historia nos permite situarnos dentro de una continuidad biológica que comenzó mucho antes de nuestra especie. Somos los herederos de un legado genético antiguo, marcado por la resistencia, la adaptación y la creatividad. Cada resto arqueológico, cada fragmento de ADN rescatado del polvo del tiempo, nos recuerda que la evolución no es simplemente un relato de cambios biológicos, sino la crónica de cómo la vida encuentra siempre modos de persistir.
5. Herencia humana y patrones hereditarios complejos
La genética humana es un campo especialmente complejo por la enorme diversidad genética de nuestra especie y por el hecho de que muchas características no dependen de un solo gen, sino de la interacción de varios genes y del entorno. A diferencia de los modelos simples descritos por Mendel —que funcionan muy bien en organismos como las plantas de guisante—, muchos rasgos humanos no siguen esquemas tan lineales. Por eso, en genética humana se estudian distintos patrones de herencia que reflejan mejor esta complejidad.
Profundizar en la herencia humana implica aceptar que el organismo no es solo el resultado de un conjunto de instrucciones, sino de la manera en que esas instrucciones dialogan entre sí y con el mundo. En los seres humanos, la combinación de miles de variantes genéticas diferentes crea un mosaico irrepetible en cada individuo. A ello se suman factores como la nutrición, el ambiente social, el estrés, la exposición a sustancias químicas y las experiencias vitales, que pueden modular la expresión de los genes y, en algunos casos, influir incluso en generaciones posteriores.
Muchos rasgos que consideramos cotidianos —la estatura, el color de la piel, el riesgo de padecer enfermedades cardiovasculares o la forma en que metabolizamos ciertos fármacos— no son el resultado de un solo gen dominante o recesivo, sino de complejas combinaciones poligénicas. En estos casos, cada gen aporta un pequeño efecto y la suma de todos ellos, junto con el entorno, determina el resultado final. Este tipo de herencia muestra que los genes rara vez actúan solos: forman redes interdependientes que cooperan, se regulan y, en ocasiones, se compensan unas a otras.
Además, la genética humana incorpora otros fenómenos que añaden matices todavía más profundos, como la impronta genómica, la herencia ligada al cromosoma X, las mutaciones espontáneas, la epigenética y la influencia de variaciones estructurales del ADN. Todos estos elementos contribuyen a que la predicción hereditaria no sea un ejercicio mecánico, sino un análisis probabilístico que requiere interpretar patrones, antecedentes familiares y características ambientales.
Entender la herencia humana desde esta perspectiva más amplia nos permite liberarnos de ideas simplistas y acercarnos a una visión más realista, rica y fascinante. No somos copias de nuestros padres, sino expresiones únicas de una combinación genética que se entrelaza con la historia personal de cada individuo. El estudio de los patrones hereditarios complejos ayuda a explicar por qué existen semejanzas evidentes entre familiares, pero también diferencias profundas, y por qué ciertos rasgos pueden saltar generaciones, manifestarse de manera tenue o expresarse solo bajo determinadas condiciones.
En conjunto, la genética humana revela que la herencia es un proceso dinámico, flexible y lleno de matices. Un proceso en el que intervienen la biología, el entorno y la historia evolutiva de nuestra especie, componiendo un cuadro extraordinariamente diverso que explica, en última instancia, lo que significa ser humano.
5.1 Herencia autosómica dominante y recesiva
Las enfermedades autosómicas son aquellas que se deben a genes localizados en los autosomas, es decir, en los 22 pares de cromosomas que no determinan el sexo.
La herencia autosómica dominante y recesiva es uno de los pilares de la genética humana, pero en realidad es mucho más matizada y rica de lo que se suele presentar en los manuales. Estos patrones se refieren a genes ubicados en los autosomas, es decir, en los 22 pares de cromosomas que comparten hombres y mujeres por igual. A diferencia de los genes situados en los cromosomas sexuales, los genes autosómicos no dependen del sexo para expresarse, lo que permite estudiar estos patrones de forma relativamente directa.
En la herencia autosómica dominante, basta con que un individuo herede una sola copia alterada del gen para que se manifieste el rasgo o la enfermedad. Esto significa que un progenitor afectado tiene un 50 % de probabilidad de transmitir ese rasgo a cada uno de sus hijos. A nivel biológico, lo dominante no implica necesariamente “más fuerte” o “mejor”, sino simplemente que esa variante del gen es suficiente para modificar el funcionamiento celular, incluso si la otra copia heredada es normal. Algunas enfermedades de este tipo son extremadamente visibles desde la infancia, mientras que otras pueden aparecer en la edad adulta, influir en la susceptibilidad a ciertas patologías o incluso presentar una penetrancia incompleta, donde no todos los portadores muestran el rasgo. Esto último introduce una dimensión de incertidumbre especialmente relevante en genética clínica.
En la herencia autosómica recesiva ocurre lo contrario. Para que un rasgo recesivo se exprese, una persona debe heredar dos copias alteradas del gen, una de cada progenitor. Los individuos que poseen solo una copia mutada no suelen mostrar síntomas y se conocen como portadores. Este patrón puede hacer que ciertas enfermedades reaparezcan inesperadamente en familias donde no existía un antecedente evidente, porque durante generaciones la mutación pudo circular de forma silenciosa. Enfermedades poco frecuentes como la anemia falciforme o la fibrosis quística siguen este tipo de herencia, aunque también existen rasgos recesivos benéficos o neutros que pasan desapercibidos y contribuyen a la diversidad humana.
Las poblaciones humanas muestran particularidades interesantes en estos mecanismos. En grupos pequeños, aislados geográficamente o culturalmente, ciertos alelos recesivos pueden hacerse más comunes debido al azar o a fenómenos históricos, creando patrones hereditarios muy característicos. A la vez, algunos alelos recesivos han persistido porque, en estado de portador, ofrecían ventajas evolutivas en ciertos entornos. Este equilibrio entre riesgo y beneficio muestra que la genética es, en esencia, un diálogo constante entre azar, selección natural y herencia.
Por último, aunque estos modelos se describen como “simples”, la realidad humana tiende a ser más compleja. La expresión de un alelo dominante puede variar entre personas; algunos rasgos recesivos pueden estar modulados por otros genes; y existen mutaciones nuevas que surgen en un individuo sin haber estado presentes en la familia. El estudio de la herencia autosómica, por tanto, permite comprender tanto la estabilidad de ciertos rasgos como la imprevisibilidad que caracteriza a la vida.
En este tipo de herencia, el rasgo o enfermedad puede ser:
- Dominante: basta con heredar una sola copia del gen alterado para que se manifieste la característica o enfermedad. Un ejemplo clásico es la enfermedad de Huntington, una dolencia neurológica progresiva.
- Recesiva: es necesario heredar dos copias defectuosas del gen (una del padre y otra de la madre) para que el rasgo se exprese. Si solo se hereda una copia, la persona será portadora, pero no desarrollará la enfermedad. Un ejemplo es la fibrosis quística, una enfermedad genética que afecta los pulmones y el sistema digestivo.
5.2 Herencia ligada al sexo
Los seres humanos tienen un par de cromosomas sexuales: XX en las mujeres y XY en los varones. Algunos genes están localizados en el cromosoma X, y cuando se alteran pueden causar enfermedades. Estas enfermedades se denominan ligadas al cromosoma X.
- En los hombres, que solo tienen un cromosoma X, cualquier gen defectuoso en ese cromosoma se expresará, porque no tienen una copia adicional que lo compense.
- En las mujeres, al tener dos cromosomas X, una copia defectuosa puede ser compensada por la otra.
Un ejemplo clásico es la hemofilia, una enfermedad que impide la correcta coagulación de la sangre, y que históricamente ha afectado a varones en muchas familias reales europeas.
También existen casos menos frecuentes de herencia ligada al cromosoma Y, pero solo pueden transmitirse de padres a hijos varones, y suelen estar relacionados con características del desarrollo masculino.
La herencia ligada al sexo hace referencia a aquellos caracteres cuyo gen está situado en los cromosomas sexuales. En la mayoría de los organismos, incluidos los seres humanos, el sexo está determinado por un sistema cromosómico XX (hembra) / XY (macho). Esto implica que los genes localizados en el cromosoma X o en el cromosoma Y no se transmiten de la misma forma que los genes situados en los autosomas.
Genes ligados al cromosoma X
El cromosoma X contiene un número elevado de genes esenciales, muchos de los cuales no tienen equivalente en el cromosoma Y. Esto genera un patrón hereditario característico:
Las mujeres tienen dos cromosomas X (XX) y, por tanto, dos copias de cada gen ligado a éste.
Los hombres tienen un solo cromosoma X (XY), por lo que solo poseen una única copia de esos genes.
Debido a esto, un hombre expresa directamente cualquier alelo que se encuentre en su cromosoma X, incluso si es recesivo, porque no tiene una segunda copia que pueda compensarlo. A este fenómeno se le llama hemicigosis.
Por qué los varones expresan más trastornos ligados al X
En enfermedades recesivas ligadas al cromosoma X (como el daltonismo o la hemofilia clásica), ocurre lo siguiente:
Una mujer debe heredar dos alelos recesivos para manifestar la enfermedad, uno de cada progenitor.
Un hombre solo necesita heredar un alelo recesivo, normalmente de su madre, para expresarlo.
Así se explica que ciertas enfermedades sean más frecuentes en varones.
Transmisión característica en familias
Los cruces en los caracteres ligados al X presentan patrones típicos:
Un hombre afectado no transmite el alelo mutado a sus hijos varones (porque les da el cromosoma Y), pero todas sus hijas serán portadoras, ya que reciben su cromosoma X.
Una mujer portadora tiene un 50% de probabilidad de transmitir el alelo mutado a su descendencia:
Si se lo transmite a una hija → será portadora.
Si se lo transmite a un hijo → estará afectado.
Este tipo de transmisión produce árboles genealógicos con un patrón muy reconocible.
Genes ligados al cromosoma Y
Los genes situados en el cromosoma Y son pocos, pero se heredan de manera muy simple:
Solo los varones lo poseen.
Un padre transmite su cromosoma Y a todos sus hijos varones, y a ninguno de sus hijos mujeres.
Los caracteres ligados al Y muestran herancia estrictamente patrilineal. Son ejemplos:
· el gen SRY, que desencadena el desarrollo de los testículos.
· ciertos marcadores utilizados en estudios genealógicos y poblacionales.
Genes influenciados por el sexo
Existen genes situados en autosomas cuyos efectos dependen del ambiente hormonal del individuo. Son los llamados caracteres influenciados por el sexo.
No están en los cromosomas sexuales.
Se expresan de forma diferente en hombres y mujeres.
Un ejemplo clásico es la calvicie androgenética, donde un mismo gen puede comportarse como dominante en hombres y recesivo en mujeres debido a los niveles hormonales.
Genes limitados por el sexo
Son autosómicos pero solo se expresan en un sexo, aunque estén presentes en ambos.
Ejemplos en animales:
producción de leche (solo en hembras).
desarrollo de cuernos en algunas especies (solo en machos).
5.3 Herencia mitocondrial
A diferencia del resto de genes, que se encuentran en el núcleo celular, el ADN mitocondrial se localiza en las mitocondrias, que son orgánulos celulares encargados de la producción de energía. Las mitocondrias solo se heredan de la madre, ya que el óvulo aporta la mayor parte del contenido citoplasmático al embrión.
Esto significa que una mutación en el ADN mitocondrial será transmitida a todos los hijos e hijas de una mujer afectada, pero solo las hijas podrán pasarla a la siguiente generación. Las enfermedades mitocondriales suelen afectar órganos que consumen mucha energía, como el cerebro, el corazón o los músculos.
La herencia mitocondrial describe la transmisión de los genes que se encuentran en el ADN mitocondrial (ADNmt), localizado dentro de las mitocondrias, los orgánulos responsables de producir la energía que utiliza la célula (mediante la fosforilación oxidativa). A diferencia del ADN del núcleo, que está distribuido en cromosomas y sigue las leyes de Mendel, el ADN mitocondrial tiene su propio patrón de herencia y funcionamiento.
Origen materno de las mitocondrias
Durante la fecundación, el óvulo aporta casi todo el material citoplasmático al embrión, incluidas las mitocondrias. El espermatozoide aporta esencialmente el núcleo con su ADN, y las mitocondrias paternas se destruyen inmediatamente después de la fecundación. Por ello, las mitocondrias se heredan exclusivamente de la madre.
Consecuencia directa:
Una mujer transmite su ADN mitocondrial a todos sus hijos e hijas.
Solo las hijas lo transmitirán a la siguiente generación.
Los hijos varones pueden estar afectados, pero no pueden transmitir la alteración.
Este patrón es característico y permite identificar rápidamente la herencia materna en los árboles genealógicos.
Número de copias y sensibilidad a las mutaciones
Cada célula contiene muchas mitocondrias, y cada mitocondria posee varias copias de ADNmt. Esto significa que pueden coexistir, dentro de una misma célula, mitocondrias “sanas” y mitocondrias “mutadas”.
A esta mezcla se le llama heteroplasmia.
Si la proporción de mitocondrias mutadas es pequeña, puede que no haya síntomas.
Si esa proporción supera un determinado umbral, aparece la enfermedad.
El nivel de heteroplasmia puede variar entre distintos órganos y tejidos.
Este fenómeno explica por qué dos hermanos pueden heredar la misma mutación pero manifestar la enfermedad con distinta gravedad.
Funciones esenciales del ADN mitocondrial
Aunque la mayor parte de las proteínas mitocondriales se codifican en el núcleo, el ADN mitocondrial contiene genes clave:
13 genes relacionados con la cadena respiratoria, encargada de producir energía.
22 genes para ARN de transferencia (ARNt).
2 genes para ARN ribosómico (ARNr).
Como estos genes están directamente vinculados a la producción de energía, cualquier mutación afecta a procesos metabólicos esenciales.
Órganos más afectados
Los tejidos que consumen grandes cantidades de energía suelen ser los más vulnerables. Por eso las enfermedades mitocondriales afectan con mayor frecuencia a:
Cerebro y sistema nervioso (encefalopatías, neuropatías).
Músculos (debilidad muscular, intolerancia al ejercicio).
Corazón (miocardiopatías).
Ojos (pérdida progresiva de visión).
Oído interno (sordera neurosensorial).
Riñones y páncreas, en algunos síndromes metabólicos.
Ejemplos de enfermedades mitocondriales
Algunas de las patologías más conocidas relacionadas con alteraciones del ADNmt son:
Neuropatía óptica hereditaria de Leber (LHON): provoca pérdida súbita de la visión central.
Síndrome MELAS: encefalomiopatía mitocondrial con acidosis láctica y episodios parecidos a ictus.
Síndrome MERRF: epilepsia mioclónica con fibras rojas rasgadas.
Síndrome de Kearns-Sayre: afecta a músculos oculares, corazón y sistema nervioso.
Estas enfermedades suelen aparecer en la infancia o juventud, aunque algunas pueden manifestarse en la edad adulta dependiendo del nivel de heteroplasmia.
Mutaciones y envejecimiento
El ADN mitocondrial es especialmente vulnerable a las mutaciones porque:
Está muy cerca de la zona donde se producen los radicales libres.
Carece de sistemas de reparación tan eficientes como el ADN nuclear.
La acumulación de mutaciones mitocondriales a lo largo de los años se ha relacionado con procesos de envejecimiento y con enfermedades neurodegenerativas como el Parkinson y el Alzheimer, aunque este campo sigue en estudio.
La herencia mitocondrial en estudios de población y evolución
El ADNmt es útil para investigar:
Líneas maternas a lo largo de generaciones (genealogía genética).
Migraciones antiguas de poblaciones humanas.
La identificación de restos arqueológicos o históricos.
Su alta estabilidad y herencia exclusivamente materna permiten reconstruir genealogías profundas, como la famosa “Eva mitocondrial”, un concepto que describe la ascendencia materna común más reciente de los seres humanos actuales.
5.4 Herencia poligénica y multifactorial
Muchas características humanas, como la estatura, el color de piel o el riesgo de padecer ciertas enfermedades (diabetes tipo II, hipertensión, enfermedades cardíacas) no están determinadas por un único gen, sino por la acción combinada de varios genes. Esto se conoce como herencia poligénica.
Cuando además de los genes intervienen factores ambientales como la alimentación, el estilo de vida o el entorno, hablamos de herencia multifactorial. En estos casos, la genética puede predisponer a una persona a desarrollar una condición, pero no garantiza que esta se manifieste. Por ejemplo, una persona con predisposición genética a la diabetes tipo II puede no desarrollarla si mantiene una dieta equilibrada y hace ejercicio regular.
Muchas características humanas no dependen de un único gen, sino de la interacción de múltiples genes, cada uno con un efecto pequeño pero acumulativo. A este patrón se le llama herencia poligénica. Cuando además intervienen factores del ambiente —como la alimentación, el ejercicio, la exposición a tóxicos o el estrés— hablamos de herencia multifactorial.
Estas dos formas de herencia explican la enorme variabilidad que existe entre las personas y la dificultad de predecir ciertos rasgos únicamente a partir de la información genética.
Herencia poligénica: rasgos determinados por muchos genes
En la herencia poligénica participan varios genes situados en distintos cromosomas. Cada uno aporta una pequeña parte del resultado final. Ningún gen determina por sí solo la característica: es la suma de efectos lo que define el rasgo.
Ejemplos claros de rasgos poligénicos son:
estatura
color de piel, ojos y cabello
forma del cuerpo
inteligencia en sentido amplio (componentes cognitivos medibles)
susceptibilidad básica a ciertas enfermedades
Los rasgos poligénicos se distribuyen normalmente siguiendo una curva de campana (distribución normal): la mayoría de las personas presentan valores intermedios, mientras que los valores muy altos o muy bajos son menos frecuentes. Esto explica la gran diversidad de tallas, tonos de piel o capacidades humanas.
Cómo actúan los genes en un rasgo poligénico
Los genes que participan en un rasgo poligénico no suelen tener un efecto “todo o nada”, como ocurre en muchos rasgos mendelianos. En su lugar:
cada gen aporta una pequeña cantidad a la característica,
algunos alelos aumentan el valor del rasgo (por ejemplo, más melanina en la piel o mayor estatura),
otros alelos lo reducen,
y los efectos se combinan y se sumarán.
En resumen: los rasgos poligénicos son el resultado de una contribución acumulativa.
Herencia multifactorial: genética + ambiente
Cuando, además de la combinación genética, intervienen factores externos que modifican el resultado, hablamos de herencia multifactorial. Aquí, el genotipo establece una predisposición, pero el ambiente decide en gran medida si esa predisposición se expresa o no.
Ejemplos típicos:
diabetes tipo II
hipertensión arterial
enfermedades cardiovasculares
obesidad
asma
ciertos tipos de cáncer (predisposición más influida por el entorno que por un único gen)
osteoporosis
La interacción genética-ambiente es tan compleja que dos personas con predisposición pueden evolucionar de forma muy distinta en función de su estilo de vida.
El concepto de “umbral” en enfermedades multifactoriales
En muchas enfermedades multifactoriales se utiliza el modelo de umbral:
Todos tenemos una cierta predisposición genética acumulada.
Esa predisposición se combina con factores ambientales.
La enfermedad solo aparece cuando la suma supera un determinado umbral.
Este umbral varía entre personas y explica por qué algunas desarrollan una enfermedad con pocos factores de riesgo y otras no la desarrollan aun estando expuestas a los mismos factores.
Ejemplo: diabetes tipo II
Una persona puede tener una combinación de genes que aumentan su predisposición a la resistencia a la insulina. Sin embargo:
una dieta equilibrada,
el ejercicio regular,
mantener un peso saludable,
y evitar el estrés crónico
pueden impedir que esa predisposición llegue a manifestarse.
Por el contrario, una persona con predisposición baja pero sometida a un estilo de vida poco saludable puede desarrollar la enfermedad.
Así funciona la interacción multifactorial: genética que abre la puerta + ambiente que decide si se cruza o no.
Importancia biológica y médica
Los rasgos poligénicos y multifactoriales explican:
por qué las características humanas muestran un abanico tan amplio de variaciones;
por qué muchas enfermedades comunes no siguen patrones mendelianos simples;
por qué entender solamente el genoma no basta para predecir el riesgo individual de enfermedad;
y por qué las recomendaciones de salud (alimentación, ejercicio, hábitos de vida) son tan efectivas incluso cuando hay predisposición genética.
Este tipo de herencia es el que mejor describe la complejidad de la biología humana.
5.5 Ejemplos prácticos
- Color de ojos: está influido por varios genes que regulan la cantidad y el tipo de melanina en el iris. No es un rasgo puramente mendeliano.
- Altura: se estima que más de 100 genes diferentes influyen en la altura de una persona, además de factores como la nutrición durante el crecimiento.
- Diabetes tipo II: tiene una clara base genética, pero su aparición depende también del estilo de vida y la dieta.
- Enfermedades cardíacas: pueden heredarse predisposiciones, pero su desarrollo depende en gran parte de hábitos como el tabaquismo, el ejercicio físico y la alimentación.
6. Técnicas avanzadas en genética molecular
La genética molecular ha experimentado un desarrollo extraordinario en las últimas décadas, impulsada por técnicas de laboratorio cada vez más precisas y potentes que permiten analizar, manipular y modificar el ADN con un nivel de detalle que antes era inimaginable. Herramientas como la reacción en cadena de la polimerasa, la secuenciación de nueva generación, la edición genética con sistemas como CRISPR y el estudio avanzado de proteínas y ácidos nucleicos han transformado por completo la investigación científica. Gracias a estas tecnologías, hoy es posible conocer en profundidad cómo funcionan los genes, cómo se regulan y cómo se alteran en diferentes condiciones biológicas.
Este progreso no se limita al ámbito académico: ha tenido un impacto directo en la medicina, la agricultura, la biotecnología, la industria farmacéutica y la ciencia forense. En el campo biomédico, la genética molecular ha permitido identificar mutaciones responsables de enfermedades hereditarias, diseñar terapias dirigidas que actúan sobre dianas específicas y comprender mejor procesos complejos como el cáncer, las enfermedades neurodegenerativas o los trastornos metabólicos. En agricultura, ha facilitado el desarrollo de variedades más resistentes a plagas, sequías o suelos pobres, mientras que en la medicina forense ha permitido resolver casos con cantidades ínfimas de material biológico y mejorar la identificación humana con una exactitud notable.
Este conjunto de técnicas ha convertido al ADN en una herramienta central para comprender la vida en todos sus niveles. La genética molecular ha dejado de ser un área especializada para convertirse en la base de la biología contemporánea, un motor tecnológico que sigue abriendo puertas y planteando preguntas sobre la naturaleza, la herencia, la salud y el futuro de la especie humana.
La genética molecular ha experimentado un desarrollo acelerado en las últimas décadas gracias al avance de técnicas de laboratorio que permiten manipular, analizar y modificar el ADN de forma precisa. Estas herramientas han revolucionado la investigación biomédica, la agricultura, la medicina forense y la biotecnología. A continuación, se presentan algunas de las más relevantes:
6.1 PCR (Reacción en Cadena de la Polimerasa)
La PCR, desarrollada en 1983 por Kary Mullis, es una técnica que permite amplificar pequeñas cantidades de ADN para obtener millones de copias de un fragmento específico. Esta técnica es fundamental en la investigación genética, en el diagnóstico de enfermedades, en pruebas de paternidad y en medicina forense.
El procedimiento consiste en calentar el ADN para separar sus cadenas, añadir cebadores (secuencias cortas de ADN que delimitan el fragmento que se desea copiar) y utilizar una enzima llamada ADN polimerasa para sintetizar nuevas cadenas complementarias. Este ciclo se repite muchas veces, duplicando exponencialmente el número de copias.
Gracias a la PCR, se puede detectar la presencia de un virus en una muestra (como se hizo masivamente durante la pandemia de COVID-19) o identificar mutaciones genéticas responsables de enfermedades hereditarias.
La reacción en cadena de la polimerasa, más conocida como PCR, es una de las técnicas más revolucionarias de la biología moderna. Desde que Kary Mullis la desarrolló en 1983, ha transformado por completo el estudio del ADN porque permite obtener millones de copias de un fragmento específico partiendo de una cantidad mínima de material genético. Antes de su aparición, analizar una pequeña muestra de ADN era extremadamente difícil; ahora, gracias a esta herramienta, incluso una sola célula puede proporcionar información suficiente para estudios genéticos completos.
El proceso se basa en imitar la forma natural en que la célula replica su ADN, pero haciéndolo de manera controlada en un tubo de laboratorio. Primero se calienta la muestra para separar las dos hebras de la molécula de ADN. Después se añaden cebadores, pequeñas secuencias que delimitan la región que se quiere copiar, y se incorpora una enzima resistente al calor llamada ADN polimerasa, capaz de sintetizar nuevas cadenas complementarias. Este ciclo de calentamiento y enfriamiento se repite muchas veces, duplicando la cantidad de ADN en cada ronda y generando una amplificación exponencial del fragmento deseado.
La PCR no solo permite copiar ADN, sino que se ha convertido en una herramienta fundamental para detectar cambios, mutaciones y microorganismos invisibles. Es un pilar en el diagnóstico clínico, la identificación de agentes infecciosos y la medicina de precisión. Durante la pandemia de COVID-19, esta técnica se convirtió en un instrumento cotidiano para detectar la presencia del virus a partir de cantidades minúsculas de ARN viral. En genética médica permite identificar mutaciones heredadas que aumentan el riesgo de enfermedades, detectar alteraciones cromosómicas y confirmar diagnósticos que antes eran prácticamente inaccesibles. En biología forense posibilita analizar restos biológicos muy degradados, como pelos, manchas de sangre o células epiteliales, y obtener perfiles genéticos válidos para investigaciones criminales o pruebas de filiación.
Con el paso del tiempo han surgido variantes que amplían aún más sus posibilidades. La PCR cuantitativa o PCR en tiempo real permite medir la cantidad exacta de ADN o ARN presente en una muestra, lo que resulta esencial para seguir la evolución de infecciones, evaluar la carga viral o estudiar la expresión génica. La PCR digital ofrece una precisión extraordinaria, útil para detectar mutaciones extremadamente raras en muestras complejas. Existen también versiones diseñadas para trabajar directamente con ARN, como la RT-PCR, usada para estudiar la actividad de los genes y para detectar virus cuyo material genético no es ADN.
En conjunto, la PCR es una herramienta que abrió la puerta a la biología molecular moderna. Su impacto abarca desde la investigación básica hasta la clínica, pasando por la biotecnología, la agricultura y la medicina personalizada. Gracias a ella es posible estudiar la secuencia de un gen, identificar patógenos, mejorar cultivos, conocer la evolución de una enfermedad o entender la biología íntima de los seres vivos con una precisión que parecía imposible hace apenas unas décadas.
6.2 Electroforesis de ADN y secuenciación genética
La electroforesis es una técnica que permite separar fragmentos de ADN según su tamaño, utilizando un gel y un campo eléctrico. Las moléculas de ADN, que son cargadas negativamente, se desplazan a través del gel hacia el polo positivo. Los fragmentos más pequeños avanzan más rápidamente, lo que permite compararlos visualmente en un patrón de bandas. Esta técnica es útil para analizar perfiles genéticos, comprobar resultados de PCR o identificar variaciones genéticas.
La secuenciación genética, por su parte, es el proceso mediante el cual se determina el orden exacto de las bases (A, T, C, G) en una molécula de ADN. La primera gran secuenciación completa fue la del genoma humano, finalizada en 2003 tras más de una década de trabajo. Actualmente, la secuenciación es mucho más rápida y accesible, lo que ha abierto el camino a la medicina personalizada y al estudio comparativo de genomas de distintas especies.
La electroforesis de ADN es una de las técnicas centrales de la biología molecular y constituye un método sencillo pero extremadamente eficaz para observar y comparar fragmentos de material genético. Su principio se basa en que el ADN posee carga negativa, de modo que, al aplicarse un campo eléctrico sobre un gel especial, los fragmentos comienzan a desplazarse hacia el polo positivo. Este gel actúa como una especie de tamiz molecular: los fragmentos de mayor tamaño se mueven con más dificultad y avanzan lentamente, mientras que los más pequeños atraviesan la matriz con mayor facilidad. Al finalizar el proceso se obtiene un patrón visible de bandas, una especie de huella molecular que permite determinar el tamaño de los fragmentos y compararlos entre sí. Por esta razón, la electroforesis resulta indispensable para verificar si una PCR ha funcionado correctamente, analizar perfiles genéticos en estudios forenses, detectar mutaciones, identificar organismos o estudiar la variabilidad genética en investigaciones de laboratorio.
La secuenciación genética representa un paso más allá, pues no se limita a separar fragmentos, sino que permite leer literalmente la información contenida en el ADN. Secuenciar consiste en determinar el orden exacto de las bases nitrogenadas —adenina, timina, citosina y guanina— que forman la molécula. Ese orden es el que establece las instrucciones que guían la actividad celular, el desarrollo de un organismo y la transmisión de los caracteres hereditarios. Las primeras técnicas de secuenciación, como el método de Sanger, eran laboriosas y lentas, pero supusieron un avance extraordinario que abrió la puerta al mayor proyecto científico genético de la historia: el secuenciamiento completo del genoma humano, anunciado en 2003. Desde entonces, las tecnologías de secuenciación han evolucionado de manera vertiginosa. Hoy es posible descifrar un genoma humano completo en pocas horas y a un coste muy reducido, algo impensable hace apenas dos décadas.
El desarrollo de estas técnicas ha tenido un impacto profundo en la biomedicina y en las ciencias de la vida. La secuenciación masiva ha permitido identificar mutaciones responsables de enfermedades hereditarias, comprender mejor la arquitectura genética de trastornos complejos, analizar la diversidad humana y reconstruir la historia evolutiva de numerosas especies. En medicina, ha abierto el camino hacia terapias más personalizadas, ya que conocer el perfil genético de un paciente ayuda a ajustar tratamientos, anticipar riesgos o seleccionar medicamentos más eficaces. En microbiología, ha permitido detectar patógenos con gran precisión, seguir la evolución de virus y bacterias en tiempo real y diseñar estrategias de control mucho más específicas. En conjunto, tanto la electroforesis como la secuenciación forman parte del núcleo de técnicas que sostienen la genética moderna y han transformado nuestra manera de estudiar la vida a escala molecular.
Visualización digital del ADN y tecnologías moleculares — © HeroImages.
6.3 CRISPR/Cas9 y edición genética
CRISPR (siglas de Clustered Regularly Interspaced Short Palindromic Repeats) es una herramienta revolucionaria de edición genética inspirada en un sistema de defensa bacteriano. Junto a la enzima Cas9, permite localizar un fragmento específico de ADN y cortarlo con precisión.
Lo más innovador del sistema CRISPR/Cas9 es su capacidad para modificar el genoma de forma dirigida. Se puede insertar, eliminar o reemplazar genes específicos, lo que abre posibilidades enormes en investigación básica, terapias génicas y tratamientos experimentales de enfermedades como el cáncer o ciertas dolencias hereditarias.
Aunque sus aplicaciones son prometedoras, también plantea importantes debates éticos, especialmente cuando se trata de modificar embriones humanos o alterar el ADN de especies silvestres.
CRISPR/Cas9 se ha convertido en una de las herramientas más transformadoras de la biología moderna, no solo por su precisión, sino por la facilidad con la que permite intervenir en el genoma de prácticamente cualquier organismo. Su origen se encuentra en un mecanismo de defensa bacteriano: ciertas bacterias guardan fragmentos de ADN de virus que las han atacado y los emplean como una especie de “memoria inmunitaria” para reconocerlos y neutralizarlos. A partir de este sistema natural, los científicos desarrollaron una tecnología capaz de localizar secuencias concretas dentro del ADN y modificarlas con una exactitud que antes parecía imposible.
La base del método es sencilla en apariencia: una molécula guía de ARN reconoce la secuencia que se desea editar, la enzima Cas9 actúa como tijera molecular y produce un corte exacto en ese punto, y el propio sistema de reparación de la célula se encarga de unir los extremos. Este proceso puede aprovecharse para eliminar un gen, corregir una mutación o introducir una secuencia nueva. La posibilidad de editar de forma dirigida convierte a CRISPR en una herramienta extremadamente versátil para estudiar la función de los genes, crear modelos experimentales de enfermedades o intentar corregir alteraciones genéticas responsables de patologías humanas.
En los últimos años, la tecnología ha evolucionado hacia versiones más sofisticadas, como la edición de bases, que permite cambiar una única letra del ADN sin realizar cortes completos, o la edición prime, que actúa como una especie de “buscador y reemplazador” capaz de modificar secuencias con una precisión aún mayor. Estas mejoras han ampliado las posibilidades terapéuticas, especialmente en enfermedades hereditarias causadas por mutaciones concretas, donde corregir el gen defectuoso puede evitar el desarrollo de la patología. CRISPR también se está empleando en investigación oncológica, ya sea para identificar genes implicados en la proliferación tumoral o para desarrollar estrategias experimentales que potencien la respuesta inmunitaria frente a células cancerosas.
Sin embargo, la potencia de esta herramienta ha generado también un intenso debate ético. La posibilidad de editar embriones humanos, aunque en muchos países está prohibida, plantea preguntas profundas sobre los límites de la intervención genética y los riesgos de modificar la línea germinal, cuyos cambios serían heredables. Además, el uso de CRISPR en ecosistemas naturales, por ejemplo mediante impulsos genéticos diseñados para alterar poblaciones de insectos o controlar enfermedades transmitidas por mosquitos, abre escenarios de gran impacto ecológico que requieren una regulación rigurosa y una reflexión colectiva. A pesar de estas preocupaciones, CRISPR/Cas9 representa uno de los mayores avances científicos de nuestra época, una herramienta capaz de transformar la biología, la medicina y la tecnología si se utiliza con prudencia, responsabilidad y un sólido marco ético.
6.4 Ingeniería genética y organismos modificados genéticamente (OMG)
La ingeniería genética es el conjunto de técnicas que permite alterar el material genético de un organismo para dotarlo de nuevas características. Esta modificación puede realizarse introduciendo genes de otra especie o modificando sus propios genes.
Los organismos modificados genéticamente (OMG) han sido utilizados ampliamente en la agricultura para desarrollar plantas más resistentes a plagas, sequías o herbicidas, y con mayor rendimiento nutricional (por ejemplo, el arroz dorado enriquecido con vitamina A).
En medicina, se usan bacterias modificadas para producir insulina humana o vacunas, y en investigación, ratones transgénicos permiten estudiar enfermedades humanas de forma controlada.
La ingeniería genética ha revolucionado la biotecnología moderna, aunque su uso genera controversia social y requiere regulación estricta por sus posibles impactos ecológicos y éticos.
La ingeniería genética es el conjunto de técnicas que permiten intervenir directamente en el ADN de un organismo para modificarlo de manera precisa y deliberada. A diferencia de la selección tradicional, que depende del cruce natural y de la herencia mendeliana, la ingeniería genética permite introducir cambios que la propia especie nunca desarrollaría por sí sola, ya sea incorporando genes de otros organismos, modificando la secuencia existente o regulando la expresión de ciertos rasgos. Estas herramientas han transformado la biología moderna al ofrecer la posibilidad de diseñar características nuevas, estudiar funciones celulares específicas y producir sustancias de interés médico o industrial con una eficiencia antes impensable.
Los organismos modificados genéticamente, conocidos como OMG, se utilizan ampliamente en agricultura. Gracias a estas técnicas se han desarrollado plantas capaces de resistir plagas, virus o herbicidas, así como variedades tolerantes a la sequía, a la salinidad o a temperaturas extremas. En algunos casos, la modificación también busca mejorar el valor nutricional de los cultivos, como ocurre con el arroz dorado, diseñado para producir beta-caroteno, precursor de la vitamina A, y destinado a combatir deficiencias nutricionales en regiones con dietas muy dependientes de este cereal. Estos avances han permitido aumentar los rendimientos agrícolas, reducir pérdidas y asegurar cosechas más estables en condiciones climáticas adversas, aunque también han generado dependencias económicas hacia las empresas que producen las semillas y han planteado debates sobre la preservación de la diversidad agrícola.
En el ámbito médico, la ingeniería genética ha supuesto una auténtica revolución. Bacterias y levaduras modificadas producen hoy insulina humana, hormonas, enzimas terapéuticas y vacunas de forma segura y masiva. La posibilidad de introducir genes humanos en estos microorganismos permitió sustituir la antigua insulina porcina o bovina por versiones idénticas a la humana, mejor toleradas y más eficaces. Además, los modelos animales transgénicos, como los ratones modificados, se han convertido en herramientas esenciales para estudiar enfermedades genéticas, comprender procesos complejos como el cáncer o la neurodegeneración y ensayar tratamientos antes de aplicarlos en humanos.
No obstante, el uso de OMG también trae consigo controversias sociales, éticas y ecológicas. Una de las principales preocupaciones es la posibilidad de que genes introducidos en cultivos comerciales se propaguen hacia plantas silvestres o variedades tradicionales, alterando ecosistemas y reduciendo la diversidad genética. También se debate sobre la dependencia de los agricultores respecto a grandes corporaciones y sobre las patentes que restringen el intercambio libre de semillas. Desde el punto de vista ético, la manipulación genética sigue generando preguntas sobre los límites de la intervención en la vida y sobre las consecuencias a largo plazo que aún no conocemos. Por ello, la ingeniería genética está sometida a regulaciones estrictas que buscan equilibrar su enorme potencial con la necesidad de garantizar la seguridad ambiental, la transparencia y el uso responsable de la tecnología.
En conjunto, la ingeniería genética y los organismos modificados genéticamente representan una de las herramientas más poderosas de la biotecnología moderna. Su capacidad para transformar la agricultura, la medicina y la investigación científica es incuestionable, pero su impacto debe gestionarse con prudencia, conocimiento y una visión global que tenga en cuenta tanto los avances que permiten como las responsabilidades que exigen.
La ingeniería genética, al permitir la creación de organismos modificados genéticamente, ha generado una revolución silenciosa pero profunda en la biotecnología contemporánea. Sus aplicaciones abarcan desde la agricultura hasta la medicina, y cada avance abre un abanico de posibilidades que hace apenas unas décadas resultaban inimaginables. En el ámbito agrícola, los OMG han permitido obtener plantas capaces de sobrevivir a condiciones que antes limitaban su expansión: cultivos resistentes a sequías prolongadas, a suelos salinos o a determinados insectos y hongos. El caso del “arroz dorado”, enriquecido con provitamina A, ilustra bien cómo una modificación genética puede aspirar a resolver un problema global de salud pública, como la ceguera infantil asociada a déficit vitamínicos en regiones donde el arroz es alimento básico. De forma similar, el maíz Bt, modificado para producir una proteína insecticida, reduce drásticamente las pérdidas por plagas y permite disminuir el uso de pesticidas químicos, aunque también ha generado debates sobre los posibles efectos ecológicos a largo plazo.
En medicina, los avances han sido aún más significativos. Las bacterias modificadas genéticamente llevan décadas produciendo insulina humana, una innovación que transformó la vida de millones de personas con diabetes al reemplazar la antigua insulina de origen animal. Hoy, otras proteínas terapéuticas, hormonas y vacunas se producen de manera similar. En investigación biomédica, los modelos animales transgénicos, especialmente los ratones modificados para expresar genes humanos, han permitido estudiar enfermedades complejas como el Alzheimer, el cáncer o ciertas patologías metabólicas, facilitando el diseño de nuevos tratamientos experimentales. Además, la posibilidad de editar genes concretos mediante técnicas como CRISPR está impulsando terapias dirigidas que van más allá del tratamiento sintomático, aspirando a corregir directamente las bases biológicas de una enfermedad.
A pesar de sus beneficios, la ingeniería genética plantea cuestiones éticas y ecológicas de largo alcance. La liberación de organismos modificados en ecosistemas naturales puede alterar equilibrios frágiles, y la dependencia agrícola de semillas patentadas genera debates sobre autonomía alimentaria y justicia económica. Asimismo, el potencial de modificar embriones humanos o alterar poblaciones enteras de especies silvestres introduce dilemas morales que exigen prudencia, transparencia y regulación internacional. Estas controversias no niegan el valor de la ingeniería genética, pero recuerdan que su uso debe estar acompañado de evaluación crítica y responsabilidad colectiva.
En el futuro, es probable que la ingeniería genética se dirija hacia enfoques más finos y específicos, como la edición base por base, la corrección de mutaciones en tejidos concretos o el diseño de microorganismos capaces de degradar contaminantes ambientales. También se espera que adquiera un papel central en la medicina personalizada, al permitir terapias ajustadas al perfil genético de cada paciente. Paralelamente, la agricultura podría avanzar hacia variedades más sostenibles y nutritivas, adaptadas al cambio climático y producidas con menor impacto ecológico. Sin embargo, todo progreso dependerá de un marco ético sólido, de sistemas regulatorios transparentes y de una participación social informada.
En conjunto, la ingeniería genética representa una de las herramientas más poderosas con las que cuenta la ciencia moderna. Su potencial para mejorar la salud, la alimentación y el medio ambiente es enorme, pero solo podrá realizarse plenamente si se combina con una visión humanista que ponga la vida y el bienestar colectivo por encima del beneficio inmediato. Integrar estas tecnologías con responsabilidad es quizá uno de los mayores desafíos del siglo XXI, y también una oportunidad histórica para construir un futuro más equilibrado, justo y sostenible.
Una agricultora de negocios se para en un campo de maíz con un portapapeles y examina las mazorcas de maíz. Concepto de agricultura. © Maxbelchenko.

Anexo_: Herencia humana, cultivos y modificación genética: diversidad, crecimiento y futuro de la agricultura
La imagen de una agricultora observando un campo verde de maíz resume bien el dilema actual de la agricultura: queremos plantas que crezcan más, más rápido y con menos riesgos, pero al mismo tiempo necesitamos conservar la diversidad, cuidar los ecosistemas y respetar la pluralidad de formas de vida y de cultivo. La modificación genética —en sus distintas formas— entra justamente en ese cruce de caminos.
Hablar de transgénicos, edición genética o variedades mejoradas no es solo hablar de laboratorio: es hablar de comida diaria, de paisajes rurales, de campesinos concretos y de la forma en que organizamos nuestras sociedades.
I. Variabilidad genética y mejora de plantas: de lo tradicional a lo biotecnológico
Desde hace miles de años, los agricultores han modificado genéticamente las plantas, aunque sin llamarlo así: seleccionaban las semillas de los mejores ejemplares y las volvían a sembrar. Con el tiempo, esto ha creado variedades de maíz, arroz, trigo y otros cultivos muy diferentes de sus antecesores silvestres.
Podemos distinguir tres grandes niveles:
Mejora tradicional
Selección de semillas de las plantas más productivas, más resistentes, más sabrosas.
Cruces entre variedades de la misma especie.
Resultado: gran diversidad de tipos de maíz, arroz, etc., adaptados a climas y culturas distintas.
Mejora “moderna” o industrial
Uso de cruzamientos dirigidos, hibridación, análisis de caracteres cuantitativos.
Aparición de variedades híbridas comerciales, muy productivas pero a menudo homogéneas.
Aumenta el rendimiento, pero también se favorece la uniformidad genética.
Biotecnología y modificación genética directa
Introducción de genes concretos (transgénicos) o cambios precisos (edición genética).
Por ejemplo, plantas resistentes a insectos, a herbicidas, a sequía o a salinidad.
La intervención ya no se limita a cruzar lo que la naturaleza puede cruzar por sí misma.
La cuestión no es solo si las plantas “funcionan” mejor, sino qué tipo de agricultura estamos construyendo alrededor de estas tecnologías.
II. Diversidad genética: riqueza o fragilidad
La diversidad genética es como un seguro de vida para la agricultura. Cuanto más variado es el conjunto de variedades de maíz, arroz o trigo:
más posibilidades hay de que algunas resistan una plaga nueva,
de que otras aguanten una sequía extrema,
o de que ciertas variedades se adapten a cambios climáticos imprevistos.
El problema aparece cuando el sistema agrícola se orienta casi exclusivamente hacia unas pocas variedades muy productivas, diseñadas para funcionar bien con fertilizantes, pesticidas y riego abundante. Esa lógica puede hacer que:
se abandonen variedades locales tradicionales;
se pierda diversidad en los campos y en los bancos de semillas campesinas;
y la producción mundial dependa de un número reducido de genotipos.
La modificación genética, usada dentro de un modelo muy industrial, puede acelerar esa homogeneización: si una variedad transgénica o editada se convierte en dominante, otras desaparecen por falta de uso o de mercado. No es un problema “técnico” del gen en sí, sino de cómo se usa y qué modelo económico se refuerza.
III. Crecimiento y rendimiento: beneficios reales y preguntas incómodas
Es innegable que muchas variedades modificadas genéticamente permiten:
aumentar el rendimiento por hectárea;
reducir pérdidas por insectos o enfermedades;
producir más alimento en menos superficie.
En un mundo con población creciente y con suelos limitados, esto se presenta como una solución razonable. Sin embargo, la pregunta de fondo es:
¿Más kilos de maíz o de arroz significan automáticamente una mejor alimentación y una agricultura más justa?
No siempre. A veces se incrementa la producción, pero:
los agricultores se endeudan para comprar semillas y agroquímicos;
la dieta se vuelve más monótona (mucho cereal, poca diversidad de alimentos);
y los sistemas locales tradicionales se desplazan por modelos dependientes de grandes empresas.
Es decir: el crecimiento biológico de la planta y el crecimiento humano (en salud, autonomía y calidad de vida) no siempre van de la mano.
IV. Variabilidad, ambiente y riesgos ecológicos
Cuando una planta se modifica genéticamente para resistir un insecto o un herbicida, no solo se altera su propio comportamiento, sino también:
las poblaciones de insectos (que pueden desarrollar resistencias),
la flora silvestre cercana (por flujo de genes o cambios en el uso de herbicidas),
y la dinámica ecológica del paisaje (simplificación de hábitats, pérdida de polinizadores).
La variabilidad genética dentro del cultivo puede reducirse, pero también la variabilidad biológica del entorno (menos insectos, menos plantas silvestres, menos aves). Un campo enorme de una sola variedad, por muy “eficiente” que sea, es un ecosistema muy pobre y muy vulnerable.
En cambio, la agricultura ecológica y la agroecología suelen apostar por:
rotaciones de cultivos,
mezcla de variedades,
márgenes con vegetación diversa,
y técnicas menos dependientes de un único tipo de semilla o química.
Aquí surge el conflicto de fondo: un modelo agrícola basado en la uniformidad y el control vs. un modelo basado en la diversidad y la resiliencia.
V. Problemática social: quién controla la genética y las semillas
La modificación genética no es solo un tema biológico, sino también político y económico.
Algunos puntos clave:
Las variedades transgénicas o editadas suelen estar protegidas por patentes o derechos de propiedad intelectual.
Esto limita la práctica tradicional de guardar semillas de un año para otro y refuerza la dependencia del agricultor respecto a la empresa.
Los pequeños campesinos pueden perder capacidad de decisión sobre qué sembrar, cuándo y cómo.
Frente a esto, hay iniciativas que reivindican:
la soberanía alimentaria (derecho de los pueblos a decidir su sistema agroalimentario);
el intercambio libre de semillas tradicionales;
y una ciencia más participativa, donde los agricultores no sean solo consumidores de tecnología, sino también protagonistas en el diseño de las soluciones.
VI. Hacia una agricultura más ecológica y plural: ¿qué tipo de soluciones?
La pregunta no es “modificación genética: sí o no”, sino en qué marco, con qué fines y bajo qué condiciones. Si pensamos en una agricultura más ecológica y plural, se abren varias líneas posibles:
Recuperar y multiplicar la diversidad local
Apoyar bancos de semillas campesinas y programas de conservación de variedades tradicionales.
Fomentar la siembra de cultivos diversos, no solo de una especie y una variedad.
Integrar saberes tradicionales sobre manejo del suelo, del agua y de las plagas.
Uso prudente y selectivo de la biotecnología
Aplicar la edición genética o la mejora avanzadas para reducir la necesidad de agroquímicos, mejorar la resistencia a sequía, salinidad o enfermedades, sin reforzar monocultivos gigantescos.
Desarrollar proyectos públicos o cooperativos, no solo corporativos, donde los beneficios lleguen a las comunidades rurales.
Agroecología como horizonte
Diseñar sistemas agrícolas que imiten la lógica de los ecosistemas: diversidad, reciclaje de nutrientes, policultivos, integración de ganado y cultivo.
Valorar no solo los kilos producidos, sino también la salud del suelo, la diversidad de especies, la calidad del agua y la calidad de la dieta.
Regulación democrática y participación social
Establecer normas claras sobre ensayo, liberación y etiquetado de cultivos modificados genéticamente.
Incluir en el debate a agricultores, consumidores, científicos y comunidades locales, no solo a gobiernos y empresas.
Asegurar la transparencia: informar con claridad de riesgos, beneficios e incertidumbres.
VII. Una mirada de conjunto
La modificación genética de cultivos como el maíz o el arroz puede ser una poderosa herramienta para:
mejorar rendimientos,
adaptarse al cambio climático,
reducir ciertas plagas.
Pero, usada dentro de un modelo que empobrece la diversidad, concentra el poder y simplifica los paisajes, puede agravar la fragilidad de los sistemas agrícolas y reducir la pluralidad ecológica y cultural.
La alternativa no es volver al pasado sin más, sino avanzar hacia una agricultura que combine conocimiento científico y respeto a la diversidad:
ciencia al servicio de la vida, no solo del beneficio inmediato;
campos productivos, sí, pero también ricos en formas de vida;
agricultores que no sean simples operadores de tecnología, sino guardianes de semillas y de paisajes.
La foto de la agricultora mirando el maizal, en este contexto, puede leerse casi como una pregunta silenciosa:
¿Qué tipo de futuro estamos sembrando cuando modificamos la vida vegetal?
¿Uno más homogéneo y controlado, o uno más diverso, justo y abierto?Esa es, en el fondo, la verdadera “herencia” que está en juego.
Investigación genética, un científico que ve la información del ADN en las pantallas. © Image-Source.

La lectura profunda del genoma: hacia una medicina preventiva, molecular y de precisión
La imagen muestra a un investigador frente a un panel iluminado con patrones de ADN, una escena que simboliza la transición histórica que vivimos: la medicina ha pasado de observar síntomas visibles a interpretar información invisible, escrita en el interior de cada célula. El estudio del genoma humano ha abierto una ventana completamente nueva para entender la salud, la enfermedad y el futuro de la prevención médica.
Hoy, la información genética ya no es solo un recurso para laboratorios especializados, sino un soporte esencial para una medicina más precisa y personalizada. La lectura de secuencias completas del ADN —sumada al análisis del epigenoma, las proteínas y los mecanismos moleculares internos— permite detectar predisposiciones individuales a enfermedades antes de que éstas se manifiesten. Este cambio convierte al diagnóstico en un proceso anticipatorio: prever, y no solo tratar; acompañar, y no solo reaccionar.
En este terreno se mueve también la llamada medicina biológica o nuclear, que emplea trazadores, marcadores radiactivos y técnicas de imagen molecular para observar procesos invisibles dentro del cuerpo humano. Estas tecnologías permiten identificar alteraciones metabólicas o celulares en etapas muy tempranas, mucho antes de que aparezcan signos clínicos. La combinación entre datos genómicos y medicina nuclear está empezando a crear una nueva disciplina híbrida: una medicina que no solo mira lo que ocurre, sino por qué ocurre y qué ocurrirá si no se interviene a tiempo.
La nanotecnología actúa como un puente entre estas áreas: diseñar partículas diminutas capaces de viajar por el organismo, reconocer células anómalas, transportar fármacos de manera selectiva o medir cambios moleculares casi imperceptibles. Este tipo de herramientas hace que el diagnóstico deje de ser una imagen estática para convertirse en un proceso dinámico, casi como seguir en directo la evolución de un tejido o la respuesta a un tratamiento.
La genómica, por su parte, sigue ampliando el mapa de lo que significa ser humano:
identifica variantes genéticas que modifican el riesgo de padecer enfermedades complejas;
aclara cómo influyen los estilos de vida en la expresión de los genes;
y permite diseñar estrategias de prevención adaptadas a la biología de cada persona.
Todas estas áreas convergen en una idea central: la medicina del futuro no espera a que la enfermedad haga su curso. Analiza, interpreta y actúa antes, utilizando la información molecular como guía.
La fotografía de este científico frente a un mosaico de secuencias de ADN refleja ese horizonte: un mundo en el que comprender los mecanismos íntimos del genoma permite intervenir con mayor precisión, proteger la salud desde sus raíces y avanzar hacia una medicina verdaderamente preventiva, informada y personalizada.
7. El Proyecto Genoma Humano
El Proyecto Genoma Humano (PGH) fue una de las mayores empresas científicas del siglo XX. Su propósito fue ambicioso: identificar y cartografiar todos los genes del genoma humano, es decir, leer letra por letra las más de tres mil millones de bases que componen nuestro ADN.
El Proyecto Genoma Humano (PGH) fue una de las mayores empresas científicas del siglo XX y un hito comparable, en ambición e impacto, a la llegada del ser humano a la Luna. Su objetivo era monumental: descifrar el mapa completo de nuestra información genética, leer uno por uno los más de tres mil millones de “letras” químicas que forman nuestro ADN y localizar todos los genes que contiene.
Aunque hoy estamos acostumbrados a oír hablar de genética, secuenciación y análisis de ADN, cuando el proyecto comenzó, a finales de los años ochenta, esto parecía casi ciencia ficción. Nunca antes se había intentado algo tan grande: comprender el manual de instrucciones de la vida humana con una precisión sin precedentes.
Para lograrlo, fue necesaria una colaboración masiva entre laboratorios de Estados Unidos, Europa y Asia, con miles de científicos compartiendo datos, técnicas y tiempo. También participaron centros de supercomputación, porque el desafío no era solo biológico: era también informático. El volumen de datos era tan enorme que obligó a desarrollar nuevas herramientas, nuevos métodos y nuevas formas de trabajar de manera coordinada.
El PGH no solo buscaba identificar los genes, sino también entender su ubicación, su organización y su funcionamiento básico, creando una especie de “atlas genético” del ser humano. Hasta ese momento, la genética se centraba sobre todo en genes aislados. El proyecto permitió, en cambio, ver el conjunto completo: un plano general de nuestro genoma, con sus regiones activas, silenciosas y regulatorias.
Cuando en 2003 se anunció su finalización —dos años antes de lo previsto— se abrió una nueva etapa en la biología moderna. El conocimiento obtenido no solo cambió la investigación biomédica, sino que transformó la forma en que entendemos la herencia, la diversidad humana, las enfermedades genéticas y nuestras propias raíces evolutivas.
Hoy sabemos que este proyecto no fue un punto final, sino un punto de partida: el comienzo de la genómica moderna, la medicina personalizada y un sinfín de aplicaciones que continúan creciendo. El PGH dejó claro que el ADN no es solo una molécula: es una historia compleja y fascinante que estamos aprendiendo a leer poco a poco.
7.1 Historia y objetivos del Proyecto Genoma Humano
El proyecto comenzó oficialmente en 1990, impulsado por instituciones de Estados Unidos y otros países bajo coordinación internacional. Su objetivo era determinar la secuencia completa del ADN humano y localizar todos los genes que codifican proteínas.
El trabajo fue complejo: implicaba leer enormes cadenas de ADN, organizarlas, interpretarlas y almacenarlas. Se trató de un proyecto interdisciplinar, que combinó biología molecular, informática, matemáticas y robótica, y que fue posible gracias a la colaboración internacional y al desarrollo de nuevas tecnologías de secuenciación y computación.
En el año 2000, los primeros borradores del genoma humano fueron anunciados públicamente, y en 2003 se publicó la versión final (aunque perfeccionada en años posteriores con tecnologías más modernas).
Representación 3D de cromosomas humanos con la doble hélice de ADN — © Vinkfan.
Representación tridimensional de varios cromosomas humanos, mostrados en detalle como estructuras compactas que contienen la doble hélice de ADN en su interior. La imagen ilustra cómo el material genético se organiza y se empaqueta dentro de los cromosomas, resaltando la relación directa entre la molécula de ADN y las unidades estructurales que forman el genoma humano. Es una visualización simbólica del proceso de mapeo y secuenciación llevado a cabo por el Proyecto Genoma Humano.
7.2 Resultados principales: el mapa del genoma humano
Uno de los hallazgos más sorprendentes fue descubrir que el genoma humano contiene aproximadamente entre 20.000 y 25.000 genes, una cifra mucho menor de lo que se había estimado inicialmente.
También se comprobó que más del 98 % del ADN no codifica proteínas. Aunque antes se consideraba “ADN basura”, hoy se sabe que muchas de estas regiones no codificantes desempeñan funciones importantes en la regulación genética, la estructura del genoma o el control del desarrollo.
Además, se identificaron miles de variantes genéticas (llamadas polimorfismos) que explican las diferencias entre individuos y que están asociadas a enfermedades, susceptibilidades o características biológicas.
Con el genoma secuenciado y el proyecto oficialmente cerrado en 2003, comenzó una segunda etapa igual de importante: interpretar ese enorme volumen de información. A lo largo de las dos últimas décadas, el análisis continuo del genoma humano ha revelado resultados inesperados y ha abierto nuevas áreas de investigación. Algunos de los avances más significativos son los siguientes:
I. El genoma humano es más dinámico de lo que se pensaba
El PGH proporcionó una fotografía fija de nuestro ADN, pero los estudios posteriores mostraron que el genoma es un sistema en movimiento:
Se descubrieron regiones móviles, como los elementos transponibles, que pueden cambiar de lugar y modificar la actividad de los genes.
Se observaron reordenamientos estructurales, duplicaciones, deleciones y variaciones en el número de copias, que influyen tanto en la salud como en la evolución.
Se comprobó que no hay dos genomas humanos idénticos: la variación estructural es tan importante como las diferencias puntuales (SNPs).
Estos descubrimientos han replanteado la idea del genoma como algo estático.
II. El papel clave del epigenoma
Tras el secuenciamiento, surgió un área crucial: la epigenética.
La secuenciación del genoma humano permitió conocer el orden exacto de nuestras bases de ADN, pero pronto se hizo evidente que la secuencia, por sí sola, no explicaba toda la complejidad de la biología humana. De esta constatación nació un campo fundamental: la epigenética. El epigenoma puede entenderse como un conjunto de marcas químicas que se añaden al ADN o a las proteínas que lo envuelven, y que regulan la forma en que los genes se activan o se silencian sin modificar la secuencia original. Estas marcas actúan como interruptores que aumentan, disminuyen o bloquean la actividad de determinados genes según las necesidades de la célula.
Una de las principales modificaciones epigenéticas es la metilación del ADN, mediante la cual se añaden pequeños grupos químicos que impiden la lectura de ciertos genes. También las histonas, unas proteínas que compactan el ADN, pueden modificarse para permitir o dificultar el acceso a determinadas regiones genéticas. Todo este sistema no cambia la “letra” del genoma, pero sí cambia profundamente su interpretación, como si la misma partitura pudiera sonar de formas distintas según quién la toque y con qué instrumentos.
Lo más interesante es que el epigenoma no es estático. Factores como la alimentación, el estrés crónico, los ritmos de sueño, la exposición a contaminantes ambientales, determinadas enfermedades e incluso las experiencias tempranas de la vida pueden modificar estas marcas químicas. Esto significa que el entorno y el estilo de vida influyen directamente en la forma en que se expresan nuestros genes, creando una interacción continua entre la biología y la experiencia. Además, se ha observado que algunas de estas marcas epigenéticas pueden heredarse, de manera que ciertos efectos del ambiente pueden transmitirse a la siguiente generación, sin necesidad de que haya cambios en la secuencia del ADN.
Todo esto revela que estudiar únicamente los genes no basta para comprender la salud, el desarrollo o la aparición de enfermedades. La expresión genética depende de estas capas regulatorias que actúan como un puente entre la información heredada y el entorno. Gracias al estudio del epigenoma, hoy sabemos que el comportamiento de un gen no está escrito de manera rígida, sino que está sujeto a modulaciones finas que determinan cómo funcionan nuestras células a lo largo de la vida. La epigenética, por tanto, complementa al genoma y nos ofrece una visión más dinámica y completa de la biología humana.
Se ha demostrado que:
El ADN está marcado por “etiquetas químicas” (como la metilación), que no cambian la secuencia, pero sí el modo en que un gen se activa o se silencia.
La epigenética está influida por la alimentación, el estrés, las toxinas o el estilo de vida.
Algunas marcas epigenéticas pueden transmitirse de generación en generación.
Se ha descubierto que estudiar solo la secuencia no basta: la expresión genética depende de estas capas regulatorias.
III. Funciones de regiones antes consideradas “ADN basura”
Gracias a proyectos posteriores, como ENCODE, se ha demostrado que amplias zonas no codificantes —antes desestimadas— cumplen funciones esenciales:
controlan cuándo, dónde y cuánto se activan los genes,
participan en el empaquetamiento del ADN,
regulan la comunicación entre regiones del genoma,
producen ARN no codificante con funciones especializadas.
Hoy se acepta que el genoma es una red regulatoria compleja donde la mayoría de su extensión no produce proteínas, pero sí organiza y modula la vida celular.
IV. Avances en medicina personalizada
Con el genoma conocimiento básico, emergió una nueva rama: la genómica médica.
La información obtenida tras la secuenciación del genoma humano impulsó el nacimiento de la genómica médica, una disciplina que ha transformado la manera en que entendemos la salud y la enfermedad. Gracias a la identificación sistemática de variantes genéticas, hoy es posible reconocer predisposiciones individuales a patologías cardiovasculares, neurodegenerativas, autoinmunes o metabólicas, lo que permite comprender por qué ciertas personas desarrollan una dolencia y otras, con estilos de vida parecidos, no la presentan. Este conocimiento también ha permitido afinar la farmacogenómica, el área que estudia cómo las diferencias genéticas influyen en la respuesta a los medicamentos. Algunas personas metabolizan fármacos demasiado rápido, otras demasiado lento; algunas presentan efectos secundarios graves debido a una variante concreta; otras necesitan dosis distintas para lograr el mismo efecto terapéutico. Conocer estos detalles evita errores, mejora la eficacia y reduce riesgos.
Paralelamente, la medicina personalizada avanza hacia la posibilidad de diseñar tratamientos basados en el perfil genómico de cada paciente. En oncología, por ejemplo, el análisis molecular de los tumores permite seleccionar terapias dirigidas contra mutaciones específicas, lo que ha mejorado la supervivencia en cánceres que antes tenían un pronóstico muy limitado. Lo mismo ocurre en enfermedades raras, donde la secuenciación completa puede revelar una mutación clave que orienta el tratamiento o incluso permite aplicar terapias génicas emergentes.
Aunque todavía no vivimos en una era plenamente personalizada —donde cada tratamiento sea único para cada individuo—, los avances de los últimos veinte años muestran un camino claro: diagnósticos cada vez más precisos, riesgos mejor calculados, intervenciones preventivas más tempranas y terapias adaptadas a las características biológicas de cada persona. La medicina deja de ser una ciencia general aplicada a todos por igual y se convierte lentamente en una disciplina que reconoce la singularidad genética de cada individuo, combinando información molecular, datos clínicos y estilo de vida para tomar decisiones más informadas.
Años después del PGH se ha logrado:
identificar variantes relacionadas con predisposición a enfermedades cardiovasculares, neurodegenerativas, metabólicas y autoinmunes,
predecir mejor la respuesta a ciertos fármacos (farmacogenómica),
diseñar tratamientos más ajustados al perfil genético del paciente.
Aunque todavía no existe una medicina completamente personalizada, estamos cada vez más cerca de diagnósticos y terapias basadas en riesgos genéticos individuales.
V. Secuenciación rápida y barata: un salto tecnológico inesperado
Uno de los resultados indirectos más revolucionarios del PGH ha sido el desarrollo de nuevas tecnologías de secuenciación:
el primer genoma humano costó alrededor de 3.000 millones de dólares,
hoy puede secuenciarse por menos de 200 euros,
y en cuestión de horas, no de años.
Este abaratamiento ha permitido usar la genómica en:
oncología,
microbiología,
investigación forense,
estudios de biodiversidad,
medicina prenatal,
e incluso en la vida cotidiana (test genéticos domésticos).
La secuenciación rápida y barata es uno de los avances más transformadores surgidos tras el Proyecto Genoma Humano. Cuando el primer borrador del genoma se completó, secuenciar una sola persona había costado cerca de tres mil millones de dólares y había requerido más de una década de trabajo coordinado entre laboratorios internacionales. Hoy el panorama es completamente distinto: la secuenciación puede realizarse por menos de doscientos euros y en cuestión de horas. Este salto tecnológico —comparable a pasar de los primeros ordenadores gigantescos a los teléfonos inteligentes actuales— se debe a una nueva generación de métodos que automatizan el proceso, reducen los errores y permiten leer enormes cantidades de ADN de forma paralela.
La caída drástica de los costes ha hecho posible que la genómica salga de los grandes centros de investigación y entre en ámbitos cada vez más variados de la medicina y la ciencia. En oncología, por ejemplo, la secuenciación permite analizar los tumores célula por célula, detectar mutaciones específicas y elegir tratamientos dirigidos con mucha mayor precisión. En microbiología se emplea para identificar microorganismos con rapidez, seguir la evolución de brotes epidémicos o estudiar cómo se adaptan las bacterias a los antibióticos. La medicina forense también se ha beneficiado, usando la secuenciación para reconstruir perfiles genéticos complejos, analizar restos mínimos y resolver casos que antes habrían resultado imposibles.
La accesibilidad de estas técnicas ha impulsado igualmente los estudios de biodiversidad, permitiendo secuenciar especies completas, reconstruir linajes evolutivos y monitorear ecosistemas sin necesidad de capturar organismos. En el ámbito de la medicina prenatal, las pruebas genéticas no invasivas —basadas en fragmentos de ADN fetal presentes en la sangre materna— ofrecen diagnósticos tempranos y seguros. Y, por último, la secuenciación ha llegado incluso a la vida cotidiana a través de servicios comerciales que analizan el genoma de una persona para ofrecer información sobre ascendencia, tolerancia a ciertos alimentos o predisposición a determinados rasgos biológicos.
Este escenario hubiera sido impensable hace apenas veinte años. La secuenciación ultrarrápida no solo ha democratizado el acceso al conocimiento genético, sino que ha inaugurado una nueva fase en la que comprender la información biológica es más rápido, más económico y más útil que nunca. Gracias a este salto, la genómica se ha convertido en una herramienta transversal, capaz de transformar desde la salud pública hasta la conservación de la naturaleza, y de acercar la biología molecular a la vida diaria de millones de personas.
VI. Reconstrucción de la historia humana
Los análisis genéticos posteriores al PGH han permitido estudiar la evolución humana con un nivel de detalle impensable antes:
Se han comparado genomas de neandertales y denisovanos con el nuestro.
Se han descrito migraciones antiguas con precisión genética.
Se ha demostrado que todos los humanos somos sorprendentemente parecidos entre sí, con variaciones pequeñas pero importantes.
Esto ha reforzado la idea de que la diversidad humana es continua y que no existen diferencias genéticas que justifiquen divisiones raciales rígidas.
Los avances en genómica posteriores al Proyecto Genoma Humano han permitido reconstruir la historia de nuestra especie con una precisión que hasta hace pocas décadas habría parecido imposible. Comparar el ADN de poblaciones actuales con el de restos fósiles ha revelado capítulos enteros de nuestra evolución que no aparecían en los registros arqueológicos. La secuenciación de los genomas neandertal y denisovano, por ejemplo, dio pie a uno de los descubrimientos más sorprendentes: los seres humanos modernos no estamos separados de ellos por una frontera absoluta, sino que hubo contactos, mezclas y compatibilidades hereditarias. Hoy sabemos que muchas personas conservan pequeños fragmentos de ADN neandertal o denisovano, prueba tangible de esa convivencia y de la compleja red de migraciones que acompañó la expansión humana fuera de África.
La genética de poblaciones ha permitido también reconstruir las rutas migratorias de la humanidad con un detalle desconocido hasta ahora. Se ha podido seguir el desplazamiento de grupos humanos desde África hacia Oriente Medio, Eurasia, Oceanía y América, identificando bifurcaciones, retrocesos y mezclas que no siempre se apreciaban en la arqueología tradicional. La comparación de miles de genomas de distintas regiones del mundo ha mostrado que la historia humana no es lineal, sino una sucesión de encuentros, intercambios y adaptaciones a ambientes diversos, desde las tundras del norte hasta las selvas tropicales.
Uno de los hallazgos más importantes de esta nueva era genómica es la constatación de que las diferencias entre los seres humanos son mínimas si se comparan con la enorme variabilidad presente en otras especies. La genética moderna ha confirmado que la mayor parte de la diversidad humana se encuentra dentro de cada población, no entre poblaciones distintas. Esto significa que dos personas de regiones geográficas diferentes pueden ser genéticamente más parecidas entre sí que dos personas de la misma región. Este hecho ha socavado de raíz la idea de que existan “razas” humanas biológicas bien definidas y ha demostrado que las categorías raciales usadas históricamente no tienen base genética, sino cultural y social.
El estudio genómico de la historia humana también ha aportado información crucial sobre cómo la selección natural ha actuado sobre nuestra especie. Se han identificado variantes genéticas que se hicieron más comunes en determinados lugares porque ofrecían ventajas adaptativas, como la tolerancia a la lactosa en pueblos ganaderos, la resistencia a la malaria en zonas tropicales o adaptaciones al frío extremo en poblaciones árticas. Estos patrones ayudan a entender no solo de dónde venimos, sino cómo la vida cotidiana, el clima, la dieta y la estructura social dejaron huellas directas en nuestro genoma.
En conjunto, la investigación genética ha transformado la forma en que interpretamos el pasado humano. Hoy vemos nuestra historia como un mosaico interconectado, tejido por migraciones constantes, mezclas entre grupos y adaptaciones sucesivas. Este conocimiento no solo ilumina el camino recorrido por la humanidad, sino que también nos recuerda que, más allá de las diferencias culturales, compartimos un origen común extraordinariamente reciente y un patrimonio biológico sorprendentemente homogéneo. La genética ha reforzado así una idea fundamental: somos una sola especie, profundamente unida por nuestra historia evolutiva y mucho más parecida de lo que nuestras diferencias superficiales podrían sugerir.
VII. Descubrimiento de miles de variantes relacionadas con rasgos comunes
A través de estudios masivos (GWAS), se han identificado miles de variantes que contribuyen a rasgos poligénicos:
estatura
tolerancia a lactosa
metabolismo de fármacos
color de ojos y piel
susceptibilidad a enfermedades complejas
Ya no se buscan “genes para la enfermedad”, sino mosaicos de pequeños efectos que, sumados, inclinan la balanza del riesgo individual.
Los estudios genómicos masivos realizados en las últimas dos décadas, especialmente los denominados estudios de asociación del genoma completo (GWAS), han permitido identificar miles de variantes genéticas dispersas por todo el ADN humano que influyen en rasgos comunes de la vida cotidiana. Estos análisis, que comparan el genoma de cientos de miles de personas, revelaron que características aparentemente simples —como la estatura, el color de ojos o la tolerancia a la lactosa— no dependen de un único gen aislado, sino de un conjunto amplio de variantes distribuidas por distintos cromosomas. Cada una de estas variantes aporta un efecto pequeño, casi imperceptible por sí sola, pero que en conjunto configuran el rasgo final. Esta constatación ha modificado profundamente la forma en que entendemos la genética humana, ya que obliga a sustituir la idea de “el gen de…” por la noción de “paisajes poligénicos”, en los que miles de piezas encajan como un mosaico.
Uno de los ejemplos más estudiados es la estatura. Lejos de estar controlada por un par de genes mayores, se ha comprobado que intervienen miles de variantes diferentes, cada una responsable de una mínima fracción del resultado. Un fenómeno similar ocurre con la pigmentación de la piel y los ojos, procesos regulados por vías biológicas complejas donde interactúan decenas de genes y mecanismos reguladores. La tolerancia a la lactosa es uno de los pocos casos de rasgos relativamente simples, asociados a una mutación concreta, pero incluso aquí se han descubierto variaciones adicionales que modulan la intensidad o duración del rasgo en distintas poblaciones.
Lo mismo sucede con la respuesta a medicamentos, un campo que ha dado lugar a la farmacogenómica. Para un mismo fármaco, diferentes personas pueden metabolizarlo de forma rápida, lenta o intermedia, y esa variabilidad se debe a múltiples variantes repartidas por el genoma que intervienen en la absorción, distribución, biotransformación y eliminación de las sustancias. Gracias a estos estudios, hoy sabemos que el metabolismo de los fármacos es uno de los rasgos humanos más poligénicos conocidos.
La susceptibilidad a enfermedades complejas —como la diabetes tipo II, la obesidad, las enfermedades cardiovasculares, la depresión o ciertos tipos de cáncer— también responde a este patrón. No existe un “gen de la diabetes” ni un “gen de la depresión”, sino cientos o miles de variantes que aumentan o disminuyen el riesgo en pequeñas proporciones. La enfermedad aparece cuando estas variantes, sumadas entre sí, alcanzan un umbral que interactúa con factores ambientales como el estilo de vida, la alimentación o el nivel de estrés. Este enfoque ha permitido elaborar puntuaciones de riesgo poligénico, herramientas estadísticas que estiman la probabilidad de que una persona desarrolle una enfermedad en función de su combinación genética global.
En conjunto, estos descubrimientos han transformado radicalmente la genética moderna: el énfasis ya no está en buscar un gen responsable de un rasgo, sino en entender la arquitectura genómica completa que sostiene la diversidad humana. Los rasgos no son piezas sueltas, sino redes complejas de pequeñas influencias acumuladas a lo largo del genoma, lo que aporta una visión más matizada, realista y humana de lo que somos biológicamente.
VIII. Aplicaciones en biotecnología y edición genética
El PGH abrió la puerta a tecnologías como CRISPR, que permiten editar genes con una precisión antes inimaginable.
Los avances son enormes:
terapias experimentales para ciertos tipos de cáncer,
estudios para corregir mutaciones hereditarias,
investigación para modificar células del sistema inmunitario,
e incluso debates éticos sobre edición en embriones.
El genoma ya no es solo algo que leemos: es algo que podemos modificar, lo que genera nuevas posibilidades y también nuevas responsabilidades.
La secuenciación del genoma humano abrió la puerta a una revolución tecnológica que ha permitido no solo leer la información genética, sino también modificarla con una precisión sin precedentes. Gracias a ese impulso inicial surgieron herramientas como CRISPR, que han transformado por completo la biotecnología moderna. La edición genética ya no es una idea teórica, sino un conjunto de técnicas capaces de alterar genes concretos, corregir mutaciones puntuales o modificar células vivas con fines terapéuticos. En el ámbito del cáncer, por ejemplo, se estudian estrategias que emplean CRISPR para desactivar genes que favorecen el crecimiento de tumores o para reprogramar células inmunitarias y hacerlas más eficaces frente a células malignas. De manera similar, se están explorando tratamientos para enfermedades hereditarias causadas por un único gen defectuoso, como la anemia falciforme o ciertas distrofias musculares, en las que la edición genética podría reparar directamente la secuencia dañada en las células del paciente.
La posibilidad de intervenir en el propio ADN también ha impulsado investigaciones destinadas a modificar células del sistema inmunitario, reforzando sus mecanismos de defensa o dotándolas de receptores específicos capaces de reconocer patógenos, virus o células tumorales de forma más efectiva. Esta línea de trabajo se cruza con la inmunoterapia moderna, que ya emplea linfocitos modificados en laboratorio para combatir células cancerosas con una eficacia que hace solo unas décadas habría sido inimaginable. Sin embargo, estos avances también generan nuevos desafíos y debates éticos de enorme importancia. La edición genética en embriones humanos, por ejemplo, plantea preguntas profundas sobre los límites de la intervención científica, la responsabilidad de alterar la línea germinal y los posibles efectos a largo plazo en generaciones futuras. También se discute la posibilidad de modificar especies silvestres para controlar enfermedades o plagas, con el riesgo de desequilibrar ecosistemas completos.
El genoma, que durante siglos se consideró un elemento intocable y puramente hereditario, ha pasado a ser un espacio de intervención técnica. Este cambio ofrece oportunidades extraordinarias para comprender y tratar enfermedades, pero también exige una reflexión social, científica y legal que acompañe el ritmo vertiginoso de los descubrimientos. La biotecnología contemporánea se mueve así en un territorio híbrido: combina una capacidad transformadora de enorme potencia con la necesidad urgente de establecer marcos éticos, regulaciones claras y un acceso equitativo a unos avances que, si se aplican con criterio y responsabilidad, pueden mejorar la vida de millones de personas.
IX. Comprensión más profunda de la expresión génica
Tras años analizando el genoma, se ha revelado:
que los genes trabajan en redes coordinadas, no de forma aislada,
que su actividad cambia según el tipo celular, la edad o el entorno,
que cada persona tiene patrones de expresión únicos.
Este conocimiento refina la idea clásica de un gen = una función.
Con el paso de los años y el desarrollo de nuevas técnicas de análisis, los científicos han comprendido que la expresión génica es un fenómeno mucho más complejo y dinámico de lo que se pensaba durante la genética clásica. El estudio continuo del genoma humano ha mostrado que los genes no funcionan como piezas aisladas, sino como elementos integrados dentro de redes de interacción, en las que la activación o el silenciamiento de un gen depende de múltiples señales internas y externas. Estas redes se comportan casi como circuitos biológicos, capaces de coordinar respuestas, ajustar procesos metabólicos y adaptarse a condiciones cambiantes. Por eso un mismo gen puede participar en rutas diferentes o desempeñar funciones distintas según el contexto celular.
También se ha comprobado que la actividad de los genes varía profundamente según el tipo de célula, la edad del organismo y los estímulos ambientales. Una célula hepática, una neurona o un linfocito comparten el mismo ADN, pero expresan conjuntos de genes completamente distintos, lo que les permite realizar funciones especializadas. A lo largo de la vida, además, la expresión génica cambia: ciertos genes son más activos en la infancia, otros en la madurez, y algunos se silencian progresivamente con el envejecimiento. El estilo de vida, la dieta, el estrés, las infecciones o la exposición a sustancias químicas influyen a su vez en estas variaciones, revelando un diálogo permanente entre el genoma y el entorno.
Otro hallazgo esencial es que cada persona presenta un patrón único de expresión genética, casi como una huella molecular propia. Aunque compartimos la gran mayoría de nuestros genes, lo que realmente nos diferencia no es solo la secuencia de ADN, sino la manera en que ese ADN se enciende y se apaga en cada individuo. Esta individualidad molecular explica, por ejemplo, por qué dos personas con predisposiciones similares pueden desarrollar trayectorias biológicas distintas, enfermar o no ante los mismos riesgos, responder de manera diferente a un medicamento o tolerar mejor ciertas condiciones ambientales.
En conjunto, esta visión más profunda de la expresión génica supera la antigua idea de que cada gen corresponde a una única función fija. Hoy se entiende que la genética es un sistema flexible, contextual y regulado por múltiples capas, donde las interacciones, los ritmos de activación y la influencia del entorno desempeñan un papel decisivo. Este avance conceptual ha transformado la investigación biológica y ha abierto nuevas posibilidades en medicina, desde diagnósticos más precisos hasta terapias personalizadas que no se basan solo en la secuencia del ADN, sino en el comportamiento real de los genes dentro del organismo.
El mapa del genoma humano; en conjunto: un legado vivo y en expansión
Años después de su finalización, el Proyecto Genoma Humano no es un recuerdo científico, sino un punto de partida:
ha cambiado nuestra manera de entender la biología y la enfermedad,
ha impulsado nuevas tecnologías,
ha reescrito la historia evolutiva de nuestra especie,
y sigue generando preguntas, aplicaciones y desafíos éticos.
El genoma humano ya no es un misterio oculto, pero tampoco es un libro completamente descifrado. Lo que tenemos hoy es un mapa, vasto y abierto, que la ciencia sigue explorando cada día.
Años después de su finalización, el Proyecto Genoma Humano no se interpreta como un logro cerrado, sino como el inicio de una nueva forma de comprender la vida. Lejos de ser un simple catálogo de genes, el genoma humano se ha convertido en una herramienta que transforma la biología desde sus cimientos. Gracias a él sabemos que la estructura genética del ser humano es más compleja, más dinámica y más variable de lo que originalmente imaginábamos. El PGH ha cambiado la manera de investigar, de diagnosticar y de pensar las enfermedades, impulsando tecnologías que han ampliado nuestro alcance hasta territorios que antes parecían inabordables: la epigenética, la edición genética, la medicina personalizada, la genómica clínica o el análisis comparado entre especies.
Su influencia también se percibe en la paleogenómica y la antropología genética, áreas que han reescrito buena parte de la historia humana al revelar nuestros vínculos con grupos extinguidos y nuestros desplazamientos a lo largo del planeta. De la misma forma, la enorme cantidad de datos generada ha estimulado la creación de nuevas herramientas informáticas y métodos de análisis que permiten manejar volúmenes de información gigantescos. Así, el genoma ha pasado a verse no como un texto fijo, sino como un sistema en constante interpretación.
Al mismo tiempo, este legado ha abierto un abanico de preguntas éticas y sociales que siguen creciendo: cómo proteger la privacidad genética, cómo garantizar el acceso equitativo a los avances, cómo evitar usos indebidos de la información y cómo avanzar en la edición genética sin cruzar límites que alteren la esencia de la vida humana o pongan en riesgo la biodiversidad. La ciencia moderna se mueve ahora en un escenario donde la frontera entre leer y modificar el ADN es cada vez más fina, y donde cada avance exige reflexión, prudencia y responsabilidad.
En conjunto, el mapa del genoma humano es una obra abierta. No es un libro terminado ni un conocimiento estático, sino un territorio enorme que apenas comenzamos a recorrer. Cada descubrimiento ilumina un aspecto nuevo de nuestra biología y, al mismo tiempo, revela vacíos que impulsan nuevas preguntas. La genética actual vive de esa tensión entre lo que ya sabemos y lo que aún queda por descifrar, avanzando hacia un futuro en el que comprender el genoma será clave para mejorar la salud, conservar la diversidad y entender, con mayor profundidad, qué significa ser humano.
7.3 Implicaciones científicas y médicas del mapa genómico humano
El conocimiento del genoma humano ha transformado la medicina, dando lugar a disciplinas como la genómica médica y la medicina personalizada. Gracias a él:
- Se pueden identificar genes asociados a enfermedades hereditarias y multifactoriales.
- Es posible predecir riesgos genéticos y anticiparse al desarrollo de ciertas dolencias.
- Se han desarrollado nuevas terapias dirigidas, basadas en el perfil genético del paciente.
- Se ha impulsado el campo de la farmacogenómica, que estudia cómo los genes afectan la respuesta a los medicamentos, permitiendo tratamientos más eficaces y con menos efectos secundarios.
El proyecto también ha servido como base para otras iniciativas genómicas (como los estudios del microbioma humano o los bancos de ADN) y ha abierto nuevas preguntas sobre ética, privacidad, acceso a la información genética y equidad en el uso de estos avances.
El conocimiento detallado del genoma humano ha transformado por completo la forma en que entendemos la salud y la enfermedad. Si durante siglos la medicina se basó en la observación de síntomas visibles, la genómica ha permitido mirar mucho más adentro: hacia las causas íntimas, moleculares, que condicionan cómo funciona cada organismo. Esta revolución ha dado lugar a nuevas disciplinas como la genómica médica, la medicina personalizada y la farmacogenómica, que trabajan con la idea de que cada individuo posee una biología única y que, por tanto, la prevención y el tratamiento deben adaptarse a esa singularidad.
Una de las contribuciones más notables del mapa genómico es la posibilidad de identificar genes asociados a enfermedades hereditarias y multifactoriales, desde trastornos monogénicos raros hasta dolencias comunes como la diabetes tipo II, la hipertensión o ciertos tipos de cáncer. Saber qué variantes genéticas posee una persona no implica un destino inevitable, pero sí permite predecir riesgos, anticiparse al desarrollo de enfermedades y actuar con una precisión que antes era imposible. La medicina, en este sentido, deja de ser exclusivamente reactiva para convertirse en una actividad preventiva y proactiva, capaz de intervenir antes de que la enfermedad tome cuerpo.
El mapa del genoma también ha impulsado el desarrollo de terapias dirigidas, tratamientos que se diseñan en función del perfil genético del paciente. En oncología, por ejemplo, conocer las mutaciones específicas presentes en un tumor permite utilizar fármacos que actúan sobre esas dianas concretas, aumentando la eficacia y reduciendo los efectos secundarios. El cáncer deja así de ser una entidad homogénea para revelarse como un conjunto de enfermedades distintas, cada una con su propio paisaje genético.
Otro campo que ha crecido con enorme fuerza es la farmacogenómica, centrada en entender cómo influyen los genes en la respuesta a los medicamentos. Gracias a ella se saben cosas que antes resultaban desconcertantes: por qué un analgésico actúa rápidamente en una persona pero apenas tiene efecto en otra, o por qué algunos tratamientos desencadenan reacciones adversas graves en determinados individuos. Con esta información, los médicos pueden ajustar las dosis, elegir moléculas más adecuadas o evitar fármacos potencialmente peligrosos, mejorando así la eficacia terapéutica y la seguridad del paciente.
El mapa genómico ha servido además como base para nuevas iniciativas científicas a gran escala. Proyectos dedicados al microbioma humano han permitido comprender cómo las comunidades de microorganismos que viven en nuestro cuerpo influyen en la digestión, el metabolismo, el sistema inmunitario e incluso el comportamiento. Los bancos de ADN y las cohortes de miles de secuencias han revelado patrones poblacionales, variantes raras y relaciones inesperadas entre genotipo y fenotipo. Este tipo de investigación colectiva, alimentada por datos compartidos, está redefiniendo el modo de hacer ciencia biomédica.
Sin embargo, esta expansión del conocimiento también ha traído consigo nuevas preguntas éticas y sociales. La capacidad de leer el genoma plantea cuestiones sobre la privacidad y el acceso a la información genética, sobre quién debería tener derecho a manejar esos datos y para qué fines. También se discute cómo garantizar que los avances en medicina genómica no amplíen las desigualdades existentes entre personas y países, y cómo evitar que la discriminación genética se convierta en un riesgo real en ámbitos como el seguro de salud o el empleo. A medida que avanzan las tecnologías de secuenciación y análisis, estas reflexiones se vuelven cada vez más urgentes.
En conjunto, el mapa del genoma humano ha inaugurado una nueva era para la biología y la medicina. No solo nos ha permitido comprender mejor la arquitectura de la vida, sino que ha abierto caminos hacia una medicina más precisa, personalizada y preventiva. Sus resultados continúan expandiéndose hacia múltiples áreas del conocimiento, recordándonos que el genoma no es un punto de llegada, sino un punto de partida para una transformación científica todavía en marcha.
7.4 Genómica comparativa (comparación del genoma humano con otras especies)
Una vez secuenciado el genoma humano, surgió una nueva línea de investigación: la genómica comparativa, que estudia y compara los genomas de distintas especies para entender la evolución, las relaciones genéticas y las funciones biológicas comunes.
Comparando nuestro ADN con el de otras especies (como chimpancés, ratones, peces o incluso bacterias), se ha descubierto que los seres vivos comparten un alto porcentaje de genes básicos, especialmente los relacionados con funciones celulares fundamentales. Por ejemplo, compartimos más del 98 % del ADN con el chimpancé, y más del 85 % con el ratón, lo que demuestra nuestra cercanía evolutiva.
Estas comparaciones ayudan a identificar genes conservados a lo largo del tiempo, comprender mejor ciertas enfermedades humanas y utilizar modelos animales para el desarrollo de tratamientos.
Genómica comparativa: más allá de las similitudes, la clave está en las diferencias funcionales
La genómica comparativa es la disciplina que analiza y contrasta los genomas de distintas especies para comprender qué elementos comparten entre sí y qué aspectos las diferencian. Después de secuenciar el genoma humano, se volvió evidente que nuestra especie no es tan distinta de otros organismos en términos de número de genes o de estructura general del ADN. Humanos, ratones, chimpancés e incluso moscas de la fruta comparten una sorprendente proporción de genes homólogos, lo que indica una historia evolutiva común.
Sin embargo, el gran avance de la genómica comparativa ha sido demostrar que las diferencias entre especies no dependen tanto de “cuántos genes tenemos”, sino de “cómo se regulan, cuándo se activan y con qué redes interactúan”. Es decir, las diferencias profundas no residen en el catálogo básico de genes —que es bastante conservado en la evolución de los vertebrados— sino en las modificaciones finas de la regulación genética, en los elementos no codificantes, en el epigenoma y en las redes de interacción molecular.
En el caso del ser humano, por ejemplo, se ha descubierto que compartimos más del 98 % de nuestro ADN con el chimpancé. Pero ese dato, aunque sorprendente, puede resultar engañoso si se interpreta sin contexto. Lo importante no es la cifra global, sino el análisis detallado de qué genes se expresan en el cerebro, con qué intensidad, en qué etapas del desarrollo, cómo responden al entorno y qué mutaciones puntuales afectan funciones clave. Es en esas variaciones sutiles donde encontramos las bases de características humanas como el lenguaje, la cognición compleja, la estructura social o el desarrollo prolongado de la infancia.
La genómica comparativa también ha mostrado que los elementos más innovadores de nuestra especie no están tanto en los genes que producen proteínas, sino en las regiones reguladoras del ADN, aquellas que controlan la activación o silenciamiento de genes durante el desarrollo. Estas regiones evolucionan más rápidamente y son responsables de la enorme diversidad entre especies estrechamente relacionadas. Así, aunque un humano y un ratón compartan gran parte de sus genes, los patrones de expresión y la arquitectura regulatoria de esos genes son radicalmente distintos, dando lugar a anatomías, fisiologías y comportamientos totalmente divergentes.
Otro aspecto fundamental que ha revelado esta disciplina es que la evolución no trabaja desde cero: no crea genes completamente nuevos para cada especie, sino que reutiliza y modifica elementos ancestrales. Las diferencias que distinguen a un pez, a un anfibio o a un mamífero son resultado de millones de años de reorganización, duplicación, pérdida de funciones y reordenamiento de elementos genéticos. Por eso la genómica comparativa permite reconstruir linajes evolutivos, entender cómo surgieron nuevas funciones biológicas y explicar el origen de innovaciones como el desarrollo del cerebro humano, la visión en color o la inmunidad adaptativa.
En ese sentido, estudiar únicamente las similitudes entre especies sería perder de vista lo más interesante. Las similitudes nos recuerdan nuestra unidad biológica, pero las diferencias nos explican nuestra diversidad evolutiva. Comparar el genoma humano con el de otras especies revela qué partes están profundamente conservadas porque cumplen funciones esenciales y qué partes han cambiado rápidamente, permitiendo la aparición de rasgos específicos. Tanto las semejanzas como las diferencias son necesarias, pero las diferencias son las que nos permiten comprender cómo han surgido los distintos caminos evolutivos y qué nos hace únicos en aspectos como la cognición, la longevidad o la estructura social.
Por eso la genómica comparativa se ha convertido en una herramienta central para la biología moderna: no solo ilumina nuestra historia evolutiva, sino que también orienta la medicina, porque muchas enfermedades humanas se estudian en modelos animales cuyos genomas son sorprendentemente parecidos al nuestro. Entender qué compartimos y en qué diferimos permite trasladar hallazgos básicos a terapias avanzadas y comprender por qué ciertos procesos funcionan de manera distinta entre especies.
En resumen, la genómica comparativa demuestra que la clave no está en que los genomas se parezcan mucho —eso ya lo sabíamos—, sino en comprender cómo esos pequeños cambios puntuales generan grandes diferencias biológicas. Esa es la esencia de la evolución molecular y una de las grandes ventanas abiertas por el Proyecto Genoma Humano.
“Humanos, chimpancés, bonobos, gorilas y orangutanes somos parientes cercanos, pero cada especie tiene algunas diferencias en sus genes: algunos genes están más copiados, otros menos. Esta imagen muestra esas diferencias y la distancia evolutiva entre nosotros.” (La figura no pretende que entiendas cada cuadrito, sino mostrar la idea general de la comparación genómica). User wikipedia: Daniel Mietchen. Original file (4,200 × 5,448 pixels, file size: 757 KB). CC-BY-2.5.
“Comparación genómica entre humano y chimpancé: similitud del 98–99 %”
📌 Fuente: Wikimedia Commons (dominio público)
El dibujo central es un árbol evolutivo. Indica que:
Humanos y chimpancés → separados hace ~2 millones de años
Chimpancé y bonobo → son más cercanos
Gorila → se separó antes (~5 Mya)
Orangután → mucho antes (~13 Mya)
Este árbol te dice quién está más o menos emparentado con quién.
Los recuadros que rodean el árbol. Esos cuadritos con colores muestran ejemplos de genes comparados entre las cinco especies.
Arriba pone:
H – B – C – G – O
que significa:
H = Humano
B = Bonobo
C = Chimpancé
G = Gorila
O = Orangután
Cada recuadro es como un pequeño mapa que dice:
“este gen está más copiado en humano” → aparece en verde
“este gen está menos copiado en humano” → aparece en rojo
o lo contrario en otras especies
👉 No hace falta entender cada gen. Lo importante es la idea: cada especie tiene aumentos o disminuciones en el número de ciertos genes.
¿Qué significa el verde y el rojo?
Abajo tienes una escala:
Verde = más copias de ese gen
Rojo = menos copias
Negro = sin cambios
Es una forma rápida de visualizar diferencias. La imagen compara genes concretos entre humano, bonobo, chimpancé, gorila y orangután. Si una especie tiene más copias del gen, aparece verde; si tiene menos, rojo. En medio está el árbol que muestra cuándo se separaron evolutivamente. Es un ejemplo visual de “genómica comparativa”.
¿En qué te debes fijar para entenderla?
Solamente en estas dos ideas:
✔ Los grandes simios estamos muy relacionados evolutivamente.
Eso lo muestra el árbol central.
✔ Aunque compartimos la mayor parte del ADN, cada especie ha ganado o perdido copias de algunos genes, y eso se ve en los recuadros verdes y rojos.
8. Genética de poblaciones
La genética de poblaciones es una rama de la genética que estudia cómo se distribuyen y cambian los genes dentro de un conjunto de individuos de la misma especie, es decir, dentro de una población. Mientras la genética clásica se enfoca en cómo se heredan los rasgos de padres a hijos, la genética de poblaciones analiza cómo actúan las fuerzas evolutivas sobre la variabilidad genética colectiva de una población a lo largo del tiempo.
La genética de poblaciones es la disciplina que estudia cómo se distribuyen los genes dentro de una población y cómo cambian con el paso de las generaciones. A diferencia de la genética clásica, que se centra en cómo se heredan rasgos de padres a hijos, la genética de poblaciones adopta una visión colectiva: observa la variabilidad genética como un conjunto dinámico que evoluciona bajo el efecto de múltiples fuerzas. Esta perspectiva permite comprender no solo por qué los individuos son diferentes entre sí, sino también cómo las poblaciones cambian a nivel genético a lo largo del tiempo.
La base fundamental de esta disciplina es la variabilidad genética, es decir, las diferencias existentes en los alelos y genes de los individuos de una población. Esa diversidad no es un simple detalle biológico, sino un recurso esencial para la supervivencia: las poblaciones con mayor variabilidad tienen más posibilidades de adaptarse a cambios ambientales, resistir enfermedades o superar catástrofes. La genética de poblaciones estudia cómo se mantiene, se reduce o se transforma esta variabilidad, analizando procesos como la selección natural, la deriva genética, las mutaciones, el flujo génico entre poblaciones y los patrones de apareamiento.
La selección natural favorece ciertos alelos que confieren ventajas adaptativas, mientras que la deriva genética —un proceso aleatorio especialmente fuerte en poblaciones pequeñas— puede cambiar la frecuencia de los genes sin relación con su utilidad. El flujo génico, por otro lado, permite que individuos de diferentes poblaciones intercambien genes, aumentando la diversidad y evitando el aislamiento genético. La genética de poblaciones estudia también el equilibrio entre mutaciones que introducen novedades y mecanismos que eliminan variantes dañinas.
A lo largo de los años, esta disciplina ha permitido reconstruir la historia evolutiva de especies enteras, comprender cómo surgieron ciertas adaptaciones y explicar por qué algunas enfermedades hereditarias son más frecuentes en unas regiones que en otras. En el caso humano, ha sido clave para estudiar migraciones antiguas, mezclas entre poblaciones, cuellos de botella genéticos y patrones de diversidad global, demostrando que todas las poblaciones humanas comparten una base genética sorprendentemente similar. La genética de poblaciones, en suma, ofrece una mirada amplia y profunda sobre cómo la evolución actúa en el nivel más íntimo: el de los genes que comparten los individuos que forman una comunidad.
8.1 Conceptos básicos: frecuencia génica, deriva genética y selección natural
En una población, cada gen puede presentarse en diferentes formas llamadas alelos. La frecuencia génica (o frecuencia alélica) es el número de veces que un alelo aparece en relación con el total de alelos para ese gen en una población. Estas frecuencias pueden cambiar de generación en generación por varias razones:
- Selección natural: los alelos que otorgan una ventaja a los individuos que los portan tienden a aumentar en frecuencia porque esos individuos tienen más probabilidades de sobrevivir y reproducirse.
- Deriva genética: cambios aleatorios en las frecuencias génicas que ocurren sobre todo en poblaciones pequeñas. Por azar, ciertos alelos pueden desaparecer o fijarse, independientemente de su valor adaptativo.
- Mutación: introduce nuevos alelos en una población. Aunque suelen ser raras, las mutaciones son la fuente última de variación genética.
- Migración (flujo génico): entrada o salida de individuos de una población. Puede introducir nuevos alelos o modificar sus proporciones.
- Apareamiento no aleatorio: cuando los individuos no eligen pareja al azar (por ejemplo, por parentesco o preferencia por rasgos similares), puede influir en la distribución genética.
8.2 Equilibrio de Hardy-Weinberg
El modelo de Hardy-Weinberg es un principio teórico que establece las condiciones bajo las cuales las frecuencias alélicas y genotípicas se mantienen constantes de una generación a otra. Es decir, si no actúan fuerzas evolutivas y se cumplen ciertos requisitos (población grande, sin mutación, sin selección, sin migración y apareamiento aleatorio), la población se encuentra en equilibrio genético.
Este modelo sirve como referencia para detectar si una población está evolucionando. Si las frecuencias observadas difieren de las predichas por el equilibrio de Hardy-Weinberg, se puede inferir que alguna fuerza evolutiva está actuando.
8.3 Migraciones, endogamia y evolución en las poblaciones
La migración altera el equilibrio génico al introducir o eliminar alelos. En poblaciones humanas, las migraciones históricas han tenido un impacto decisivo en la diversidad genética.
La endogamia (cruzamiento entre individuos emparentados) puede aumentar la frecuencia de enfermedades genéticas recesivas, ya que se incrementa la probabilidad de que los descendientes hereden dos copias de un alelo mutado.
Estos fenómenos, junto con la selección natural, la deriva genética y las mutaciones, modelan la evolución genética de las poblaciones a lo largo del tiempo, modificando la composición genética de la especie.
8.4 Aplicación en estudios evolutivos, antropológicos y médicos
La genética de poblaciones es fundamental en campos como:
- La evolución: permite rastrear cambios genéticos en especies y reconstruir árboles filogenéticos.
- La antropología genética: estudia la historia de las poblaciones humanas, las migraciones prehistóricas y los orígenes comunes.
- La medicina poblacional: ayuda a comprender la predisposición genética a ciertas enfermedades en grupos étnicos o regiones específicas, lo que permite diseñar políticas de salud más eficaces.
Gracias a la genética de poblaciones, comprendemos que la evolución no actúa solo sobre individuos, sino sobre el conjunto genético de las poblaciones, lo que proporciona una perspectiva más amplia de cómo cambia la vida en la Tierra a lo largo del tiempo.
La gráfica, es una demostración visual de la deriva genética. La deriva genética es un fenómeno que dice:
“En poblaciones pequeñas, los genes cambian mucho por azar. En poblaciones grandes, cambian muy poco.”
CÓMO SE LEE LA IMAGEN (explicado para que lo entiendas en 10 segundos)
Cada gráfico representa la misma simulación, repetida con distintos tamaños de población:
Arriba: población pequeña (n = 20)
En medio: población mediana (n = 200)
Abajo: población grande (n = 2000)
Las líneas de colores representan cómo cambia la frecuencia de un alelo (por ejemplo, el “alelo A”) a lo largo del tiempo (en generaciones).
En el eje X → generaciones (tiempo)
En el eje Y → frecuencia del alelo (entre 0 y 1)
¿QUÉ NOS DICE CADA GRÁFICO?
1️⃣ Población n = 20 (muy pequeña)
Las líneas suben y bajan muchísimo.
Algunas llegan a 1.0 → el alelo se “fija” (= todos los individuos lo tienen).
Otras bajan a 0.0 → el alelo desaparece por completo.
👉 Conclusión: en poblaciones pequeñas, el azar manda.
👉 Un gen puede desaparecer o dominar muy rápido, sin selección natural.
2️⃣ Población n = 200 (mediana)
Los cambios todavía existen, pero son menos bruscos.
Casi ninguna línea llega a 0 o a 1.
Se ve una “oscilación moderada”.
👉 Conclusión: la deriva genética sigue actuando, pero con menos fuerza.
3️⃣ Población n = 2000 (muy grande)
Las líneas casi no se mueven.
La frecuencia permanece estable en torno a 0,5.
Nada llega a desaparecer ni a fijarse.
👉 Conclusión: en poblaciones grandes, el azar tiene muy poco efecto.
👉 Las frecuencias génicas permanecen casi constantes.
En genética de poblaciones, el tamaño de una población influye directamente en cómo cambian los genes con el tiempo. En poblaciones pequeñas, las frecuencias génicas fluctúan mucho simplemente por azar; en poblaciones medianas esos cambios son más suaves; y en poblaciones grandes casi no se mueven. Esta variación aleatoria se llama deriva genética y explica por qué algunas especies pierden o fijan genes sin que intervenga la selección natural. Como decíamos, el grafico muestra el concepto central de la genética de poblaciones, explicado visualmente:
Cuanto más pequeña es una población, más cambian los genes por puro azar.
Cuanto más grande es una población, más estables son esos genes.
Esto afecta directamente a:
la evolución
la variación genética
la salud poblacional
la endogamia
la migración
y a por qué unas especies son genéticamente más diversas que otras
9. Epigenética
9.1 Conceptos básicos y definiciones: más allá del ADN
La epigenética es el estudio de los cambios en la expresión génica que no implican alteraciones en la secuencia del ADN. Es decir, dos células pueden tener exactamente el mismo ADN, pero comportarse de manera distinta porque ciertos genes están activados o desactivados según señales químicas externas. Esto significa que no solo importa el contenido genético (los genes), sino también cómo y cuándo se usan esos genes.
La palabra «epigenética» proviene del griego epi, que significa “por encima de”, lo que indica que estos mecanismos actúan “por encima del genoma”, regulando su funcionamiento sin modificar la información básica contenida en la secuencia de nucleótidos.
Gracias a la epigenética entendemos, por ejemplo, cómo una célula de la piel y una célula nerviosa pueden tener el mismo ADN, pero funcionar de manera completamente diferente. También nos ayuda a comprender cómo factores ambientales pueden afectar a la actividad genética sin cambiar los genes en sí.
9.2 Mecanismos epigenéticos (metilación, acetilación, modificación de histonas)
Los mecanismos epigenéticos más conocidos incluyen:
- Metilación del ADN: es la adición de un grupo metilo (CH₃) a ciertas bases del ADN, generalmente la citosina. Esto suele bloquear la actividad de un gen, silenciándolo sin eliminarlo. Es uno de los principales mecanismos de regulación epigenética.
- Acetilación y desacetilación de histonas: las histonas son proteínas alrededor de las cuales se enrolla el ADN para formar la cromatina. Cuando las histonas se acetilan, el ADN se relaja y los genes se vuelven más accesibles y activos. Si se desacetilan, el ADN se compacta más y los genes tienden a inactivarse.
- Modificaciones de histonas (más allá de la acetilación): las histonas también pueden sufrir otras modificaciones químicas como fosforilación o ubiquitinación, que afectan al grado de condensación del ADN y a su expresión.
- ARNs no codificantes: ciertos tipos de ARN, como los microARN, pueden regular la expresión génica al interferir con la traducción del ARN mensajero a proteínas.
Estos mecanismos permiten que el mismo genoma dé lugar a funciones celulares diferentes, dependiendo de cómo se estructure y regule la cromatina.
9.3 Herencia epigenética y transmisión generacional
Una de las áreas más fascinantes de la epigenética es la posibilidad de que algunas marcas epigenéticas se hereden de una generación a otra. Aunque muchas de estas marcas se «borran» durante la formación de los gametos o el desarrollo embrionario, algunas modificaciones pueden permanecer y transmitirse a la descendencia, afectando su desarrollo y salud.
Este fenómeno se denomina herencia epigenética transgeneracional, y sugiere que los efectos del entorno (como el estrés o la dieta) en los padres podrían influir en la expresión génica de sus hijos e incluso de sus nietos, sin necesidad de una mutación en el ADN.
Aunque la magnitud y duración de estos efectos aún están en estudio, hay pruebas sólidas en animales de laboratorio y evidencias emergentes en humanos.
9.4 Influencia del medio ambiente sobre la epigenética (alimentación, estrés, exposición a tóxicos)
La epigenética es un punto de encuentro entre genética y ambiente. Numerosos factores externos pueden alterar las marcas epigenéticas, entre ellos:
- La alimentación: nutrientes como el ácido fólico, la vitamina B12, el zinc o la colina influyen en los procesos de metilación del ADN. Una dieta inadecuada puede modificar la expresión de ciertos genes, sobre todo en etapas clave como el embarazo o la infancia.
- El estrés: experiencias de estrés prolongado o traumático pueden provocar cambios epigenéticos en los genes relacionados con el sistema nervioso y hormonal, afectando la salud mental y física.
- Exposición a tóxicos: sustancias como metales pesados, pesticidas o contaminantes industriales pueden modificar las marcas epigenéticas y alterar la expresión génica normal, lo cual se relaciona con el riesgo de enfermedades como el cáncer o trastornos metabólicos.
- Ejercicio físico, sueño y microbiota intestinal también se han asociado con cambios epigenéticos positivos o negativos, mostrando que nuestros hábitos diarios influyen en la actividad de nuestros genes.
La epigenética ha abierto una nueva dimensión en la biología: la comprensión de cómo el entorno dialoga con nuestros genes. Esta interacción dinámica entre lo genético y lo ambiental no solo modifica nuestra salud, sino que puede influir en las generaciones futuras. Comprender estos procesos es clave para una medicina más preventiva, personalizada y responsable.
Metilación del ADN: visualización de dos grupos metilo unidos a la doble hélice. Fuente: Wikimedia Commons, Autor: Christoph Bock / Max Planck Institute, CC BY-SA 3.0.
La imagen representa una doble hélice de ADN con dos grupos metilo (las esferas brillantes adheridas a las bases). Esto la convierte en una ilustración directa y correcta de la metilación del ADN, uno de los mecanismos epigenéticos fundamentales.
La metilación consiste en añadir pequeños grupos químicos —grupos metilo— sobre determinadas bases (generalmente citosinas), lo que no altera la secuencia genética, pero sí modifica la forma en que el gen se expresa. Original file (6,400 × 4,800 pixels, file size: 1.11 MB). CC-BY-SA-3.0
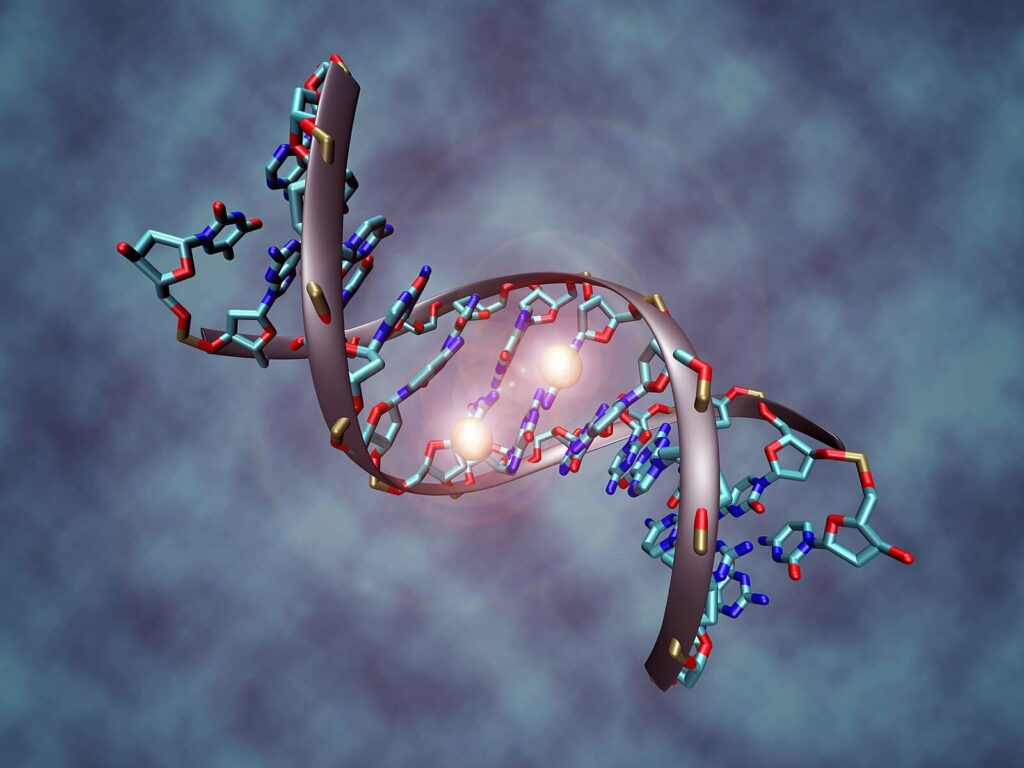
La epigenética estudia los cambios químicos que modifican la actividad de los genes sin alterar la secuencia del ADN. Uno de los procesos más importantes es la metilación, que consiste en la adición de pequeños grupos metilo sobre determinadas bases del ADN. Esta marca química actúa como un interruptor que puede silenciar un gen y hacer que quede inactivo, incluso aunque la información genética permanezca intacta.
Cuando el ADN se metila en una región concreta, la estructura se compacta ligeramente y las proteínas que leen los genes tienen más dificultad para acceder al código. Esto hace que la célula reduzca la expresión de ese gen o que lo bloquee temporalmente. El proceso es reversible y responde a señales internas y externas, como la nutrición, el estrés, el desarrollo embrionario o la exposición ambiental. Los patrones de metilación forman una especie de memoria celular que permite que cada tipo de célula mantenga su identidad y función, y que también puede alterarse a lo largo de la vida.
La epigenética muestra que el genoma no es un sistema rígido, sino un conjunto dinámico y sensible al entorno. Lo que comemos, cómo dormimos, la presencia de toxinas, la edad o incluso experiencias tempranas pueden dejar huellas químicas que influyen en la forma en que nuestros genes se activan o se apagan. Estas modificaciones no cambian el ADN, pero sí condicionan la manera en que la información genética se manifiesta en el organismo.
10. Genética médica y diagnóstico genético
La genética médica es la rama de la genética que se ocupa del estudio de las enfermedades humanas relacionadas con alteraciones en los genes o cromosomas. Su objetivo es entender el origen genético de ciertas patologías, mejorar su diagnóstico, anticipar riesgos futuros y ofrecer tratamientos personalizados.
El avance de esta disciplina ha revolucionado la medicina, permitiendo no solo identificar enfermedades hereditarias, sino también comprender cómo los genes influyen en la respuesta a medicamentos o en la predisposición a padecer ciertos trastornos.
La genética médica se ha convertido en una de las áreas más transformadoras de la medicina contemporánea. Su propósito principal es comprender cómo las alteraciones en los genes y en los cromosomas pueden dar lugar a enfermedades, síntomas o vulnerabilidades específicas, y cómo esta información puede utilizarse para mejorar la salud de los pacientes. Gracias al progreso de la biología molecular, de la secuenciación genética y de las técnicas de diagnóstico avanzado, hoy es posible detectar mutaciones que afectan a la estructura o función de los genes, identificar fallos en el número de cromosomas y analizar incluso pequeñas variaciones que aumentan el riesgo de desarrollar enfermedades complejas a lo largo de la vida.
El impacto clínico de esta disciplina ha sido profundo. Por un lado, permite diagnosticar con mayor precisión trastornos hereditarios que antes pasaban desapercibidos o se confundían con causas ambientales. Por otro, hace posible anticipar el riesgo de ciertas enfermedades antes de que aparezcan los primeros síntomas, lo que abre la puerta a programas de prevención personalizados, decisiones reproductivas informadas y tratamientos tempranos. La genética médica también ha demostrado que la manera en que cada persona metaboliza un medicamento depende, en gran medida, de variantes genéticas específicas, lo que ha dado lugar al desarrollo de la farmacogenómica: una herramienta fundamental para ajustar dosis, evitar reacciones adversas y escoger el fármaco más adecuado para cada individuo.
Con el paso del tiempo, esta disciplina se ha relacionado cada vez más con la medicina personalizada, que busca adaptar las estrategias de tratamiento según el perfil genético, molecular y clínico de cada paciente. Esto es especialmente relevante en enfermedades complejas como cardiopatías, trastornos metabólicos, patologías autoinmunes y, por supuesto, distintos tipos de cáncer. En estos casos, la genética no solo ayuda a comprender por qué surge la enfermedad, sino que también permite identificar dianas terapéuticas, predecir el comportamiento de un tumor o determinar si un tratamiento concreto será eficaz.
La genética médica también ha cambiado la forma en que entendemos la salud: ya no se trata únicamente de curar enfermedades, sino de interpretarlas a partir de su base biológica más profunda. Ha impulsado la creación de unidades especializadas, bancos de ADN, estudios familiares y programas de cribado que permiten detectar problemas genéticos en poblaciones completas. Y, al mismo tiempo, ha planteado nuevos desafíos relacionados con la ética, la privacidad de los datos, el uso responsable de la información genética y la necesidad de garantizar que estos avances lleguen a todas las personas, sin generar desigualdades.
En conjunto, la genética médica y el diagnóstico genético representan una revolución silenciosa pero decisiva en la práctica clínica: una medicina que mira dentro del genoma para comprender el presente del paciente, prevenir su futuro y diseñar intervenciones más precisas y humanas.
10.1 Principales enfermedades genéticas humanas (hereditarias y adquiridas)
Las enfermedades genéticas pueden clasificarse de varias formas, pero una distinción útil es entre hereditarias (se transmiten de padres a hijos) y adquiridas (no se heredan directamente, sino que surgen por mutaciones espontáneas o factores ambientales).
Entre las enfermedades genéticas hereditarias más conocidas se encuentran:
- Fibrosis quística: causada por una mutación en un gen que regula el transporte de sal y agua en las células, afecta sobre todo al sistema respiratorio y digestivo.
- Distrofia muscular de Duchenne: afecta a los músculos y se debe a una mutación en el gen de la distrofina, ligado al cromosoma X.
- Hemofilia: alteración en la coagulación de la sangre debida a un gen defectuoso, también ligada al cromosoma X.
- Anemia falciforme: causada por una mutación en el gen de la hemoglobina, que afecta a la forma y funcionamiento de los glóbulos rojos.
- Síndrome de Down: aunque no es una enfermedad hereditaria en la mayoría de los casos, es de origen genético por la presencia de un cromosoma 21 extra (trisomía 21).
Enfermedades genéticas adquiridas:
Algunas enfermedades como ciertos tipos de cáncer, la diabetes tipo II o el alzhéimer tienen una base genética combinada con influencias ambientales. En estos casos, no hay una sola mutación que cause la enfermedad, sino múltiples factores genéticos y externos que aumentan el riesgo.
10.2 Diagnóstico prenatal y postnatal: amniocentesis, biopsia corial, cribado neonatal
La detección de enfermedades genéticas puede hacerse antes o después del nacimiento. Las principales técnicas de diagnóstico incluyen:
- Amniocentesis: se extrae una pequeña cantidad de líquido amniótico del útero de la madre para analizar el ADN fetal. Se realiza generalmente entre las semanas 15 y 20 de embarazo.
- Biopsia corial: se toma una muestra de las vellosidades coriónicas (tejido placentario) para estudiar los cromosomas del feto. Puede hacerse antes que la amniocentesis (entre las semanas 10 y 13).
- Cribado neonatal: tras el nacimiento, se analiza una pequeña muestra de sangre del recién nacido (el famoso “pinchazo en el talón”) para detectar enfermedades metabólicas o genéticas raras pero graves, como el hipotiroidismo congénito o la fenilcetonuria. La detección precoz permite iniciar tratamiento inmediato y prevenir complicaciones.
Estas técnicas permiten diagnosticar alteraciones genéticas que, en algunos casos, pueden tratarse desde el inicio o incluso corregirse con terapias dirigidas.
Diagnóstico médico. © Stockfactory.
El diagnóstico genético se ha convertido en una herramienta esencial de la medicina moderna. Gracias a las técnicas actuales, los profesionales de la salud pueden identificar alteraciones genéticas con una precisión que hace unas décadas era impensable. En el vídeo se muestra a un médico analizando datos en pantalla, una escena que refleja la complejidad de estos procesos y, al mismo tiempo, la enorme responsabilidad que conllevan. Cada variante genética debe interpretarse con rigor, porque de su lectura dependen decisiones clínicas que pueden modificar la evolución de una enfermedad o incluso anticiparse a ella.
La identificación temprana de mutaciones y la interpretación de su significado permiten orientar tratamientos, valorar riesgos hereditarios, diseñar estrategias personalizadas y, en algunos casos, iniciar intervenciones preventivas antes de que la enfermedad se manifieste. Sin embargo, estos avances no se limitan a la tecnología; también requieren una comunicación clara y respetuosa entre médico, paciente y familia. Muchas de estas pruebas implican información sensible que afecta al propio individuo y a sus descendientes, por lo que deben realizarse siempre con pleno consentimiento y comprensión.
El proceso suele incluir conversaciones donde se explica qué tipo de análisis se hará, qué información puede revelarse y cuáles son las implicaciones médicas, emocionales y familiares de los resultados. La genética médica no solo trata de genes, sino de personas: sus decisiones, sus miedos, sus derechos y su capacidad para participar de forma informada en su propio cuidado. Cuando el paciente y su entorno comprenden el valor del diagnóstico y consienten libremente el procedimiento, la medicina genética alcanza su verdadero propósito: ofrecer conocimiento, alivio y orientación para mejorar la salud presente y futura.
10.3 Medicina predictiva y personalizada (farmacogenómica)
Una de las aplicaciones más prometedoras de la genética es la medicina personalizada, que adapta los tratamientos a las características genéticas de cada individuo. Esto incluye:
- Medicina predictiva: mediante análisis genéticos se puede calcular el riesgo de desarrollar ciertas enfermedades, como el cáncer de mama (mutaciones BRCA1/BRCA2), y adoptar medidas preventivas.
- Farmacogenómica: estudia cómo los genes influyen en la respuesta a los medicamentos. Algunas personas metabolizan los fármacos más rápido o más lentamente según su perfil genético. Con esta información, se pueden ajustar las dosis o elegir tratamientos más eficaces y con menos efectos secundarios.
Esto permite una atención médica más eficiente, con tratamientos más específicos y personalizados para cada paciente.
10.4 Ética de las pruebas genéticas y manejo de resultados
El uso de la genética médica plantea importantes dilemas éticos. Algunas cuestiones clave son:
- Consentimiento informado: las personas deben comprender plenamente qué se va a analizar y qué implicaciones pueden tener los resultados antes de someterse a una prueba genética.
- Privacidad y confidencialidad: la información genética es extremadamente sensible. Su uso debe estar regulado para evitar discriminación por razones de salud, empleo o seguros.
- Impacto psicológico: conocer que se tiene predisposición a una enfermedad grave puede causar ansiedad, angustia o conflictos familiares.
- Diagnóstico prenatal y selección genética: las pruebas genéticas durante el embarazo pueden llevar a decisiones difíciles, como la interrupción voluntaria del embarazo en caso de anomalías graves. Esto requiere un enfoque ético y cuidadoso, respetando la libertad individual y evitando prácticas eugenésicas.
Por ello, la genética médica debe ir siempre acompañada de asesoramiento genético, ofrecido por profesionales que informen y acompañen a los pacientes y sus familias en el proceso de toma de decisiones.

11. Bioética y genética
La genética ha abierto enormes posibilidades para mejorar la salud, prevenir enfermedades y entender mejor el funcionamiento del cuerpo humano. Sin embargo, estas posibilidades también han planteado preguntas complejas sobre los límites de lo que es correcto o aceptable. La bioética es la rama de la ética que se encarga de reflexionar sobre estos dilemas, especialmente cuando se trata de manipular la información genética o intervenir en la biología humana.
11.1 Debates éticos sobre manipulación genética y edición génica humana
Uno de los mayores avances de las últimas décadas ha sido la edición genética, especialmente con técnicas como CRISPR/Cas9, que permiten modificar genes de forma precisa. Esta herramienta ofrece esperanzas para corregir enfermedades genéticas graves, pero también plantea interrogantes cuando se piensa en modificar embriones humanos o en realizar cambios hereditarios (que se transmitan a futuras generaciones).
Algunos puntos clave del debate son:
- ¿Debe permitirse la edición genética en embriones humanos para evitar enfermedades graves?
- ¿Dónde está el límite entre tratar enfermedades y «mejorar» características humanas (como la inteligencia o el aspecto físico)?
- ¿Quién decide qué es deseable y qué no?
- ¿Podría surgir una nueva forma de desigualdad entre quienes pueden permitirse acceder a estas tecnologías y quienes no?
Aunque algunos países han prohibido la edición genética en embriones con fines reproductivos, otros han dejado la puerta abierta a investigaciones con controles estrictos. El consenso internacional es que, por ahora, no se debe permitir la modificación genética hereditaria hasta que se comprenda completamente su impacto biológico, ético y social.
11.2 Confidencialidad y privacidad genética
Los estudios genéticos pueden revelar información muy íntima sobre las personas: no solo su riesgo de padecer ciertas enfermedades, sino también sus orígenes familiares, relaciones biológicas o predisposición a problemas de salud mental.
Por eso, uno de los principios fundamentales en genética médica es proteger la confidencialidad de los datos genéticos. Nadie debe acceder ni utilizar esta información sin el consentimiento expreso de la persona.
Además, se plantean dudas como:
- ¿Pueden las compañías de seguros o los empleadores acceder a la información genética de una persona?
- ¿Se deben informar a los familiares si un análisis genético revela que también podrían tener una enfermedad hereditaria?
- ¿Cómo garantizar la seguridad de estos datos en bases digitales o servicios en línea de genealogía genética?
El marco legal de cada país regula estas cuestiones, pero el debate sigue abierto sobre cómo equilibrar el derecho a la privacidad con la utilidad médica o científica de compartir información genética.
11.3 Genética y discriminación: riesgos éticos y sociales
Una de las preocupaciones éticas más profundas es el riesgo de discriminación genética. Si una persona tiene un gen que la predispone a una enfermedad, podría ser tratada de forma injusta o estigmatizada. También puede ocurrir que se valore a las personas según su perfil genético, lo que recuerda peligrosas ideas del pasado como la eugenesia.
Asimismo, la selección genética puede generar desigualdades, especialmente si algunas poblaciones tienen más acceso a estas tecnologías que otras. Esto plantea el temor a una posible brecha genética, en la que algunos grupos humanos puedan modificar sus características mientras otros no tienen esa posibilidad.
Por eso, es fundamental que el desarrollo de la genética vaya acompañado de principios éticos sólidos, como:
- Igualdad de acceso a las tecnologías
- Justicia social y no discriminación
- Respeto a la autonomía personal
- Transparencia en la investigación
- Control democrático de las aplicaciones genéticas
La genética tiene un potencial inmenso, pero también requiere una profunda reflexión colectiva. El progreso científico no puede separarse de la responsabilidad ética. Solo mediante el diálogo abierto y el respeto a los derechos humanos podremos asegurar que los avances genéticos sirvan realmente para mejorar la vida de todos, sin excluir a nadie ni poner en riesgo nuestra dignidad como especie.

En la foto se muestra a un especialista examinando un perfil genético representado en forma de bandas de colores sobre una pantalla. Cada columna vertical corresponde a una región del ADN analizada mediante técnicas de secuenciación o electroforesis capilar, y los distintos colores reflejan la presencia de nucleótidos específicos o patrones de fragmentación característicos de la muestra estudiada. Para el genetista, este mosaico aparentemente abstracto constituye un mapa extremadamente preciso de las variaciones individuales presentes en el genoma. Cada franja luminosa indica la posición, la longitud y, en algunos casos, la composición química de los fragmentos analizados, permitiendo identificar mutaciones, deleciones, repeticiones anómalas o firmas genéticas asociadas a enfermedades hereditarias o adquiridas.
La alternancia de colores no es un mero efecto visual, sino un sistema codificado que permite diferenciar los cuatro tipos de bases nitrogenadas o distinguir fragmentos amplificados mediante distintas sondas fluorescentes. Según el método empleado, la intensidad de cada señal puede revelar la proporción relativa de un alelo, la presencia de mosaicismos, la existencia de duplicaciones o la pérdida de material genético en regiones concretas del cromosoma. En la práctica clínica, esta información se interpreta como un conjunto de pistas que orientan al médico hacia el diagnóstico de síndromes genéticos, predisposiciones a ciertas patologías o alteraciones asociadas a tumores.
Lo que para un observador profano parece un patrón decorativo constituye, en realidad, un lenguaje visual que traduce el genoma humano en un código legible. El especialista debe comparar estas bandas con patrones de referencia, evaluar desviaciones mínimas y contextualizar cada hallazgo en función de la historia clínica del paciente. De esa lectura dependen decisiones diagnósticas que pueden anticipar una enfermedad, confirmar una sospecha o guiar la elección de un tratamiento personalizado. En definitiva, esta representación cromática es una ventana precisa y poderosa hacia la arquitectura íntima del ADN, y uno de los instrumentos más valiosos de la genética médica contemporánea.
Por ejemplo, en el diagnóstico prenatal, estos patrones de colores ofrecen una forma temprana y precisa de examinar el material genético del feto. Al analizar fragmentos de ADN obtenidos mediante técnicas como la amniocentesis o la biopsia corial, el especialista puede detectar variaciones en el número o la estructura de los cromosomas, identificar deleciones o duplicaciones significativas y comprobar la presencia de mutaciones asociadas a enfermedades hereditarias graves. Las bandas alteradas, desplazadas o ausentes indican que una región concreta del genoma no sigue el patrón esperado, lo que permite anticipar anomalías antes del nacimiento y ofrecer a los padres información clara y fundamentada sobre la salud fetal. En este contexto, el análisis de colores no es una mera lectura técnica, sino una herramienta que ayuda a tomar decisiones médicas y éticas especialmente delicadas.
En oncología, la interpretación del patrón cromático adquiere un significado distinto. Los tumores suelen mostrar mutaciones acumuladas, inestabilidad genómica y cambios profundos en la estructura del ADN que se reflejan en perfiles irregulares, con picos de señal anómalos, fragmentos inesperados o variaciones en la intensidad de las bandas. El genetista puede identificar las mutaciones que impulsan el crecimiento del tumor y diferenciar entre alteraciones heredadas y modificaciones adquiridas durante la vida del paciente. Estas lecturas permiten clasificar el tipo de cáncer, predecir su agresividad, elegir terapias dirigidas y evaluar la respuesta al tratamiento. Cada color y cada franja aportan una pieza de un rompecabezas molecular que revela la identidad biológica del tumor y orienta la estrategia terapéutica.
En medicina personalizada, estos patrones se convierten en la base para adaptar tratamientos a las características genéticas de cada persona. El análisis de variantes específicas permite saber si un paciente metaboliza ciertos fármacos con rapidez o lentitud, si es más sensible a determinados efectos secundarios o si responderá mejor a una molécula concreta. La farmacogenómica se apoya en estas mismas señales fluorescentes para construir un perfil individual que guía la elección, la dosis y el seguimiento de los medicamentos. Al interpretar estos códigos de colores, el médico puede transformar la información genética en decisiones prácticas que mejoran la eficacia terapéutica y reducen riesgos. En conjunto, estos patrones no solo describen el genoma, sino que lo traducen en un conocimiento útil para la prevención, el diagnóstico y el tratamiento, convirtiendo a la genética en una herramienta profundamente integrada en la medicina moderna.
12. El futuro de la genética
La genética se encuentra en un momento clave de su evolución. Tras más de un siglo de descubrimientos fundamentales —desde las leyes de Mendel hasta la secuenciación del genoma humano—, hoy estamos entrando en una era marcada por la intervención directa en el material genético, con herramientas más potentes, rápidas y accesibles que nunca.
La genética se encuentra hoy en un momento decisivo. Tras más de un siglo de avances —desde las leyes de Mendel hasta el desciframiento completo del genoma humano— hemos entrado en una etapa marcada por la capacidad de intervenir directamente en el material genético con una precisión que antes era inimaginable. Herramientas como la edición genética CRISPR, las tecnologías de secuenciación ultrarrápida o la inteligencia artificial aplicada al análisis genómico están transformando la biología y abriendo posibilidades que hace solo unas décadas parecían propias de la ciencia ficción.
El futuro de la genética apunta hacia una medicina más preventiva, personalizada y molecular. Los diagnósticos tenderán a basarse en la detección de mutaciones o patrones de riesgo antes de que la enfermedad aparezca, lo que permitirá tomar medidas anticipadas y diseñar tratamientos ajustados al perfil genético de cada paciente. La ingeniería genética podría corregir mutaciones hereditarias, potenciar la respuesta inmunitaria frente a ciertos tipos de cáncer o incluso reparar tejidos dañados mediante terapias avanzadas. Al mismo tiempo, la biología sintética abre la posibilidad de crear microorganismos diseñados para funciones específicas, desde la producción de medicamentos hasta la descontaminación ambiental.
Pero este progreso viene acompañado de desafíos éticos y sociales de gran envergadura. La capacidad de modificar el genoma humano plantea preguntas sobre los límites de la intervención en la vida, la equidad en el acceso a estas tecnologías y la necesidad de regulaciones claras que protejan la dignidad y la privacidad de las personas. El futuro de la genética será, sin duda, un equilibrio entre el entusiasmo por las nuevas posibilidades y la responsabilidad de utilizarlas de forma justa y prudente. Si se gestiona con cuidado, este campo puede convertirse en una de las mayores herramientas de bienestar humano de las próximas generaciones.
12.1 Nuevas tecnologías: edición genética de precisión y terapia génica avanzada
La gran revolución actual es la posibilidad de modificar genes de forma precisa. La técnica CRISPR/Cas9, por ejemplo, permite cortar y reemplazar fragmentos específicos del ADN con un grado de precisión que antes era impensable. Esto abre la puerta a corregir defectos genéticos responsables de enfermedades como la distrofia muscular, la anemia de células falciformes o ciertas inmunodeficiencias.
Al mismo tiempo, la terapia génica avanzada está empezando a aplicarse en contextos clínicos reales. En lugar de tratar síntomas, esta estrategia busca reparar el origen genético de la enfermedad introduciendo copias funcionales de genes en células afectadas o incluso reprogramándolas. Si bien aún se encuentra en fases experimentales para muchas dolencias, se han logrado ya terapias aprobadas en algunos países para enfermedades raras.
12.2 Aplicaciones emergentes: genética sintética y biología computacional
El futuro de la genética no se limita a corregir errores: también apunta a crear y diseñar. La genética sintética se dedica a construir secuencias de ADN completamente nuevas, capaces de producir proteínas no naturales o de dar lugar a organismos con funciones inéditas. Esto tiene aplicaciones en campos como la medicina, la producción de energía limpia o la fabricación de materiales biocompatibles.
Por su parte, la biología computacional y la inteligencia artificial están revolucionando la manera de analizar la enorme cantidad de datos genéticos que genera la investigación actual. Hoy se pueden predecir estructuras de proteínas, simular interacciones moleculares o buscar mutaciones asociadas a enfermedades con una rapidez sin precedentes. Esto permitirá diagnósticos más precisos y terapias más personalizadas.
12.3 Retos y perspectivas científicas, éticas y sociales
A pesar de sus promesas, el futuro de la genética plantea retos enormes. En el plano científico, aún hay muchas incógnitas sobre cómo interactúan los genes entre sí y con el ambiente. Muchas enfermedades comunes, como la diabetes tipo 2 o la hipertensión, tienen una base genética compleja que todavía no se comprende del todo.
Desde el punto de vista ético y social, los riesgos también son reales. La posibilidad de manipular embriones, de crear organismos diseñados o de modificar líneas germinales humanas plantea dilemas morales profundos. La genética del futuro no puede desarrollarse sin un marco ético sólido y sin una participación social informada.
Además, hay que evitar que estas tecnologías profundicen las desigualdades globales. El acceso justo a la genética avanzada, la protección de la diversidad genética humana y el respeto a los derechos individuales serán claves para que los avances no beneficien solo a unos pocos.
La genética del futuro nos invita no solo a conocer mejor quiénes somos, sino también a decidir qué queremos ser. Se trata de una ciencia que no solo observa la vida, sino que empieza a escribirla. Por eso, el reto principal será avanzar con responsabilidad, con equidad y con una mirada puesta en el bien común.
La inmunoterapia representa uno de los avances más prometedores de la medicina contemporánea, y su relación con la genética es cada vez más profunda. A diferencia de la quimioterapia o la radioterapia —que actúan directamente sobre el tumor mediante sustancias tóxicas o radiación—, la inmunoterapia busca estimular, entrenar o modificar el propio sistema inmunitario para que sea él quien reconozca y destruya las células cancerosas. Esta idea, que hace décadas parecía imposible, se ha convertido hoy en una de las vías terapéuticas más eficaces y selectivas para muchos cánceres. Y es precisamente la genética la que ha permitido que estos tratamientos alcancen un nivel de precisión antes inimaginable.
La base del vínculo entre inmunoterapia y genética reside en que cada tumor tiene una identidad molecular propia. Las células malignas acumulan mutaciones que alteran sus proteínas, cambian su metabolismo y crean señales químicas que el sistema inmune puede detectar… si sabe qué buscar. Gracias a la secuenciación del ADN tumoral, es posible identificar esas mutaciones específicas, construir un “perfil genético” del cáncer y utilizar esa información para diseñar terapias dirigidas al tipo exacto de alteración presente en cada paciente. La inmunoterapia moderna no actúa a ciegas: se guía por la información genética del tumor y del propio sistema inmunitario del enfermo.
Un ejemplo revolucionario de esta relación es la terapia con células CAR-T, en la que se extraen linfocitos del paciente, se modifican genéticamente en el laboratorio para que reconozcan un marcador concreto del tumor y se reinfunden después al organismo. Estas células, reprogramadas mediante ingeniería genética, actúan como un ejército altamente especializado capaz de localizar y destruir células cancerosas con una precisión extraordinaria. Este tipo de tratamiento, impensable sin los avances en genética molecular, ha transformado el pronóstico de ciertos cánceres hematológicos que antes eran casi intratables.
Otro ámbito en el que genética e inmunoterapia se entrelazan es el de los inhibidores de puntos de control inmunitario. El tumor utiliza ciertas proteínas para “apagar” la respuesta inmunitaria y pasar desapercibido; conocer las mutaciones que producen esos mecanismos permite diseñar anticuerpos que bloqueen el freno y devuelvan la actividad al sistema inmune. Gracias al análisis genético del tumor, hoy se saben con mayor precisión qué pacientes se beneficiarán de estos fármacos y cuáles no, evitando tratamientos ineficaces y efectos secundarios innecesarios.
La comparación con terapias clásicas es inevitable. La quimioterapia destaca por su potencia, pero actúa de forma poco selectiva y daña células sanas de rápida división. La radioterapia es más localizada, pero sigue teniendo un impacto importante sobre los tejidos cercanos. La inmunoterapia, apoyada en información genética, puede alcanzar niveles de especificidad muy superiores, atacando al tumor sin perjudicar en la misma medida al resto del organismo. No sustituye a las otras terapias, pero abre una opción adicional donde los tratamientos tradicionales fallan, y se está integrando dentro de estrategias combinadas que mejoran la supervivencia y la calidad de vida.
A medida que avanza la investigación, la relación entre genética e inmunoterapia se vuelve aún más estrecha. La identificación de nuevos marcadores, la comprensión de cómo el microambiente tumoral modula la respuesta inmune, el uso de algoritmos que predicen la inmunogenicidad de mutaciones y la integración de datos del genoma, epigenoma y transcriptoma forman ya parte del trabajo diario en los centros de referencia. El futuro apunta a inmunoterapias cada vez más personalizadas, donde el tratamiento será casi “a medida” para cada paciente, basándose en la lectura exacta de sus mutaciones y en la forma en que su sistema inmunitario puede ser reforzado o reeducado.
En conjunto, la inmunoterapia representa un cambio de paradigma: no se trata de destruir el cáncer desde fuera, sino de darle al cuerpo las herramientas necesarias para que lo elimine por sí mismo. Y ese cambio solo es posible gracias al conocimiento profundo del genoma humano, del genoma tumoral y de la biología molecular que da forma a nuestra salud y a nuestras enfermedades.
La fragilidad del genoma ante la enfermedad
Este render muestra una hélice de ADN desintegrándose, como si la materia misma de la vida se fragmentara en un espacio oscuro y silencioso. La imagen simboliza con enorme fuerza visual lo que ocurre cuando una enfermedad altera, daña o corrompe los mecanismos íntimos del genoma. En el interior de cada célula, la estabilidad del ADN sostiene la continuidad del organismo; cuando esa estabilidad se quiebra, cuando las mutaciones se acumulan, cuando los sistemas de reparación fallan, el cuerpo entero entra en un territorio de vulnerabilidad extrema.
Muchas enfermedades graves —desde ciertos cánceres hasta patologías degenerativas— nacen precisamente de estos procesos silenciosos: pequeñas alteraciones en la secuencia genética, errores de replicación, roturas en los cromosomas o daños causados por radiación, tóxicos, inflamación crónica o fallos en los sistemas de control celular. Lo que empieza como una modificación microscópica puede desencadenar una reacción en cadena que desorganiza el tejido, detiene funciones vitales y, en última instancia, compromete la vida del individuo.
La imagen de la hélice desmoronándose nos recuerda que la genética no es una abstracción académica ni un conjunto de cifras en una pantalla. Es la arquitectura íntima que sostiene cada respiración, cada pensamiento y cada latido. Cuando esa arquitectura se ve erosionada por la enfermedad, se hace visible —aunque solo de manera metafórica— la fragilidad de la existencia humana.
Pero la escena no es únicamente un recordatorio de destrucción. También refleja la razón por la que la investigación biológica y médica se ha volcado en comprender, proteger y reparar el ADN. La genómica, la biología molecular, la medicina personalizada y las terapias avanzadas —desde la inmunoterapia hasta la edición genética— buscan precisamente intervenir antes de que la hélice termine colapsando. Tratan de detectar a tiempo los primeros indicios de daño, corregir mutaciones, frenar procesos malignos o reforzar los mecanismos naturales de reparación.
En última instancia, esta imagen sintetiza un doble mensaje: la vulnerabilidad de nuestro código biológico y el enorme esfuerzo científico por preservarlo. Frente al deterioro silencioso que muestran estas partículas dispersas, la investigación continúa intentando transformar el destino de muchas enfermedades, prolongando la vida allí donde la hélice amenaza con romperse. Es un recordatorio visual de lo que está en juego: la vida misma escrita en el lenguaje del ADN.
Epílogo: Comprender, cuidar y transformar la vida
La genética ha recorrido un camino asombroso desde las observaciones de Mendel con plantas de guisante hasta las técnicas modernas de edición genética y análisis de genomas completos. En apenas un siglo, pasamos de especular sobre la herencia a manipular directamente el código de la vida.
Hoy sabemos que la genética es el lenguaje con el que está escrita la diversidad biológica del planeta. Entender cómo se heredan los rasgos, cómo funcionan los genes y cómo interactúan con el entorno nos ha permitido abrir ventanas a lo invisible, descifrando los mecanismos fundamentales que gobiernan la salud, la evolución, el desarrollo y el comportamiento de los seres vivos.
Pero más allá del conocimiento, la genética ha generado herramientas poderosas para la acción. Gracias a ella, se han desarrollado diagnósticos precoces, terapias para enfermedades antes incurables, vacunas adaptadas al perfil genético, cultivos más resistentes y sostenibles, y tecnologías que permiten imaginar una medicina verdaderamente personalizada.
El reto ahora es decidir cómo usar todo ese poder. Vivimos un momento en el que podemos editar genes humanos, crear organismos sintéticos, diseñar terapias a medida o leer el genoma de poblaciones enteras. Estas capacidades traen consigo posibilidades inmensas, pero también riesgos profundos: éticos, sociales, ecológicos. ¿Dónde están los límites de la intervención? ¿Cómo evitar la desigualdad genética? ¿Quién decide qué modificaciones son aceptables?
Por eso, el futuro de la genética no solo será biológico o técnico, sino también político, filosófico y cultural. Necesitaremos educar a la sociedad, formar profesionales íntegros, fortalecer la regulación y fomentar un diálogo constante entre ciencia y ciudadanía. La genética debe avanzar al servicio del bien común, con transparencia, justicia y respeto por la dignidad humana.
En resumen, la genética no solo nos permite comprender cómo funciona la vida, sino también cómo cuidarla y, en ciertos casos, cómo transformarla. Aplicada con responsabilidad, puede ayudarnos a construir un mundo más saludable, más justo y más consciente de su propia herencia. Porque conocer el lenguaje de la vida es también una invitación a proteger su significado.
Nota del autor
Este trabajo está concebido con un propósito divulgativo e informativo, dirigido a un público general interesado en comprender los fundamentos de la genética, sus aplicaciones y su impacto en la vida cotidiana. No pretende, en ningún caso, reemplazar el criterio profesional ni sustituir la labor de los investigadores, médicos, biólogos o especialistas en ciencias de la salud.
La complejidad de la biología molecular y médica requiere una formación rigurosa y especializada. Este documento aspira únicamente a ser una puerta de entrada al conocimiento, una herramienta de apoyo para quienes desean acercarse de forma accesible pero seria a temas tan relevantes como la herencia genética, la biotecnología o la medicina del futuro.
Mi mayor respeto y admiración está dirigido a la comunidad científica y médica, cuya labor constituye una inspiración permanente. Gracias a sus descubrimientos y avances, hoy es posible imaginar un futuro con mejores diagnósticos, terapias más eficaces y una comprensión más profunda de la vida. Este trabajo intenta contribuir modestamente a la difusión de ese conocimiento, en el convencimiento de que una ciudadanía informada es clave para un debate ético y responsable sobre los desafíos que la genética plantea.
Este trabajo está editado bajo licencia Creative Commons BY-SA, lo que permite su lectura, reutilización y adaptación siempre que se mantenga la atribución y se comparta con la misma licencia. No obstante, es importante recordar que la mayoría de las imágenes y algunos de los vídeos incluidos en este capítulo están sujetos a copyright y forman parte de bibliotecas comerciales o repositorios con derechos reservados. Su uso se ha realizado dentro de los márgenes permitidos para este proyecto, pero no pueden ser copiados, distribuidos o reutilizados libremente por terceros sin la correspondiente autorización del titular de los derechos. La reproducción indebida de estos materiales podría derivar en decisiones correctivas por parte de los propietarios o, en casos extremos, en responsabilidades legales. Por ello, cualquier reutilización debe hacerse con prudencia, respetando las licencias y asegurando siempre que los derechos de autor queden debidamente protegidos.

